3.3: Subatomära partiklar – elektroner, protoner och neutroner
Identifiera och lokalisera de subatomära partiklarna
År 1897 bevisade den brittiske fysikern J. J. Thomson (1856-1940) att atomer inte var den mest grundläggande formen av materia. I sina experiment använde han sig av katodstrålerör (CRT). I en vakuumerad miljö producerar dessa apparater osynliga strålar som utgår från en negativ elektrod (katod) och fortsätter till en positiv elektrod (anod). I dessa experiment visade Thomson att katodstrålarna kunde avledas eller böjas av magnetiska eller elektriska fält, vilket tyder på att katodstrålarna består av laddade partiklar . Ännu viktigare är att Thomson, genom att mäta omfattningen av katodstrålarnas avböjning i magnetiska eller elektriska fält av olika styrka, kunde beräkna förhållandet mellan partiklarnas massa och laddning. Eftersom likadana laddningar stöter bort varandra och motsatta laddningar attraherar varandra, drog Thomson slutsatsen att partiklarna hade en negativ nettoladdning; dessa partiklar kallas nu för elektroner. Thomson fann att katodstrålarnas förhållande mellan massa och laddning är oberoende av metallelektroderns eller gasens beskaffenhet, vilket tyder på att elektroner är grundläggande komponenter i alla atomer.
Under 1910-talet ledde experiment med röntgenstrålar till denna användbara slutsats: storleken på den positiva laddningen i kärnan hos varje atom av ett visst grundämne är densamma. Med andra ord har alla atomer av samma grundämne samma antal protoner. Dessutom har olika grundämnen olika antal protoner i sina kärnor, så antalet protoner i en atomkärna är karakteristiskt för ett visst grundämne. Denna upptäckt var så viktig för vår förståelse av atomer att antalet protoner i en atomkärna kallas för atomnummer. Dessa experiment utfördes av Ernest Rutherford. Han har fått erkännande för att ha definierat en central plats i atomen som nu har fått namnet atomkärnan.
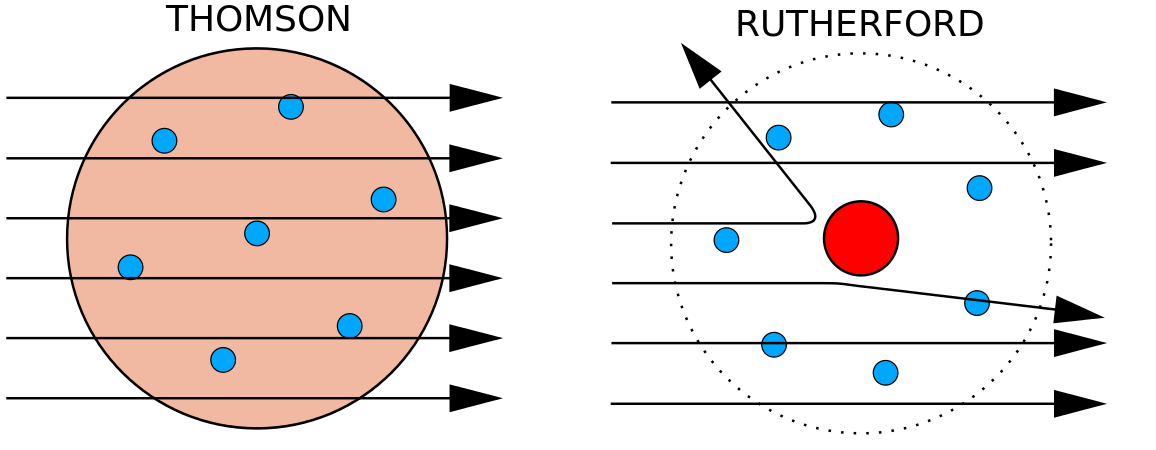
Rutherford var medveten om att protonerna befann sig inom detta område. En av Ernest Rutherfords kollegor, James Chadwick, utförde och studerade radioaktiva reaktioner av beryllium. När en berylliumkärna träffades av alfapartiklar emitterades en neutronpartikel. År 1932 meddelade James Chadwick att det fanns en tredje subatomär partikel, neutronen. Denna partikel har en massa på 1 atommassenhet, men har ingen laddning. Efter denna upptäckt startade kärnvetenskap och kärnteknik omedelbart.
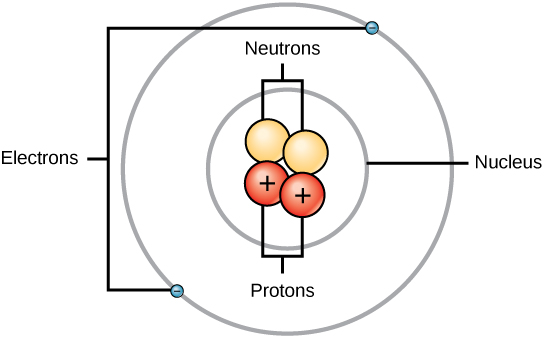
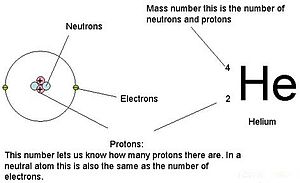
Massor för de tre subatomära partiklarna kan uttryckas i amu (atommasseenheter) eller gram. För enkelhetens skull kommer vi att använda enheten amu för de tre subatomära partiklarna. Både neutroner och protoner tilldelas en massa på 1 amu vardera. Elektronen däremot har en försumbar massa på 0,0005 amu. Denna subatomära massa representeras inte i den decimalmassa som visas i det periodiska systemet. Endast protoner och neutroner bidrar till en atoms massvärde.
en:User:Materialscientist)
För atomer (neutrala arter) motsvarar antalet elektroner antalet protoner. Som ett resultat av detta har alla atomer en total laddning på noll. För en diskussion om joner (atomer som får eller förlorar elektroner) hänvisas till den senare delen av detta kapitel. Atomer som skiljer sig i neutron- och massvärden från tabellen kallas isotoper. Dessa särskilda arter kan ses i följande avsnitt av texten.
| Subatomära partiklar | Symbol | Relativ laddning | Plats | Amu-massa |
|---|---|---|---|---|
| Proton | p | +1 | inuti kärnan | 1 |
| Neutron | n | 0 | inom kärnan | 1 |
| Elektron | e- | -1 | utanför kärnan | 0.0005 (~0) |
Exempel \(\PageIndex{1}\)
Vad är sant?
- Kärnan innehåller protoner och elektroner.
- En elektrons massa ingår i atomens massa
- För en atom är antalet protoner = antalet elektroner.
Lösning
- Sannolikt, kärnan innehåller protoner och neutroner. Elektroner finns utanför kärnan.
- Falskt, elektroner bidrar inte till atomens masstal.
- Sant, alla atomer är neutrala och måste ha lika många protoner som elektroner.




