CNIO, nya steg för en framtida terapi mot åldersrelaterad lungfibros
Gruppen för telomerer och telomeras vid det spanska nationella cancerforskningscentret (CNIO) har demonstrerat en effektiv terapi hos möss med fibros på grund av åldrande, efter att ha utvecklat samma botemedel för möss med fibros på grund av genetiska fel. I studien, som publiceras i Journal of Cell Biology, utvecklas en genterapi som aktiverar kroppens produktion av telomeras.
Idiopatisk lungfibros är en obehandlad och potentiellt dödlig sjukdom som är förknippad med vissa mutationer och även med åldrande.
Telomeras är det enzym som ansvarar för att reparera kromosomernas ändar, där telomererna finns. Behandlingen var mycket effektiv hos djur och inga biverkningar observerades. Detta förklarades av studieledaren Maria Blaso.
”Om vi tänker på människor pekar vårt resultat på möjligheten att skapa en behandling som kan förhindra utvecklingen av lungfibros i samband med åldrande hos alla patienter”, säger Blasco.
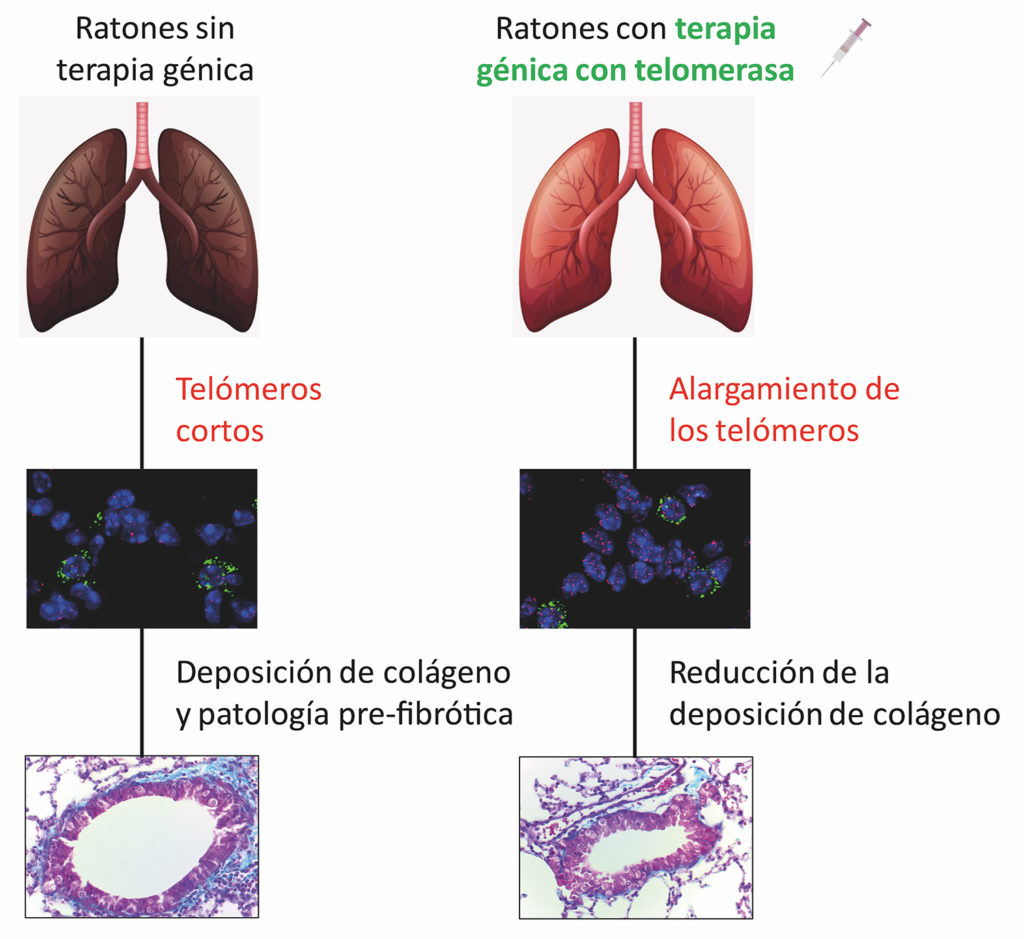
Telomer dysfunktion vid ursprunget till fibros
Lungfibros drabbar cirka 8 000 personer i Spanien. Vid denna sjukdom utvecklar lungvävnad ärrbildning och blir stel, vilket leder till en progressiv förlust av andningsförmåga.
Sin orsak tillskrivs en kombination av genetik och miljö: miljögifter spelar en viktig roll, men för att sjukdomen ska manifestera sig måste det också finnas antingen en genetisk orsak eller åldrande i samband med tidens gång.
CNIO-gruppen hade redan i tidigare studier visat att den genetiska orsaken är att telomererna fungerar dåligt. Telomerer är strukturer som likt mössor skyddar integriteten hos de kromosomer som finns i alla celler.
Under 2015 skapade de en djurmodell för lungfibros, en mus som saknar telomerasgenen. Hos dessa djur dör de celler som ansvarar för att regenerera lungvävnad, så kallade alveolära pneumocyter av typ II, så småningom på grund av telomerdysfunktion. Musen utvecklar aggressiv fibros till följd av detta, eftersom epitelet i lungorna inte kan förnyas med jämna mellanrum. Det är denna periodiska regenerering som håller vävnaden frisk och fri från skador från miljögifter.
Fibros i samband med åldrande
Denna djurmodell utan telomerasgen reproducerar väl vad som händer hos patienter vars fibros beror på mutationer som påverkar telomererna. Men dessa personer är i minoritet. Hos den stora majoriteten av patienterna finns det inget som pekar på en specifik mutation, men det finns en faktor som är gemensam för dem alla: hög ålder.

Telomererna kan också förlora sin funktion enbart genom åldrandet. Studien av hur detta sker är ett område som leds internationellt av Blascos grupp.
Telomererna är proteinhättor i kromosomernas ändar, och de blir lite kortare varje gång cellen delas. Med tanke på detta kommer det efter många celldelningar under organismens livstid en punkt då de blir så korta att de förlorar sin förmåga att skydda kromosomerna. Cellen tolkar detta som ett misstag och slutar dela sig, vilket gör att vävnaden inte förnyas.
I det nu publicerade arbetet har forskarna visat att denna åldersrelaterade telomerdysfunktion faktiskt förekommer i lungvävnadens regenerativa celler, typ II-pneumocyter. De har alltså hittat den molekylära orsaken till kopplingen mellan åldrande och lungfibros, som är så tydlig i kliniken.
Förlust av smörjmedel i lungorna
En av författarna menar att ”en av de stora framgångarna med det nya arbetet är att i detalj beskriva åldrandets effekter på lungvävnaden”. ”En av dem beror direkt på att pneumocyter av typ II slutar göra sitt jobb”, säger Sergio Piñeiro, förstaförfattare till artikeln.
Förutom att regenerera vävnad tillverkar och släpper dessa celler ut en vätska som underlättar lungans mekaniska arbete, den så kallade lungornas surfaktant.
”Lungvävnaden måste öppnas varje gång vi andas, mellan sex och tio gånger i minuten, vilket ur fysisk synvinkel är en stor ansträngning”, förklarar Jesús Pérez-Gil, expert vid Complutense-universitetet i Madrid.
Gil, som medverkade i studien och vars team är experter på det här området, påpekar att ”surfaktant i lungorna är viktigt för att smörja vävnaden, göra det möjligt för den att öppna och stänga sig med minimal ansträngning, och hålla den elastisk”.
”Om typ II-pneumocyter inte förnyas, gör inte heller surfaktant det, och detta bidrar till att lungan blir progressivt stel och fibrotisk”
Complutense-universitetet i Madrid, Jesús Pérez-Gil
I det här arbetet ”har vi observerat ett mycket tydligt samband mellan telomerstatusen hos typ II-pneumocyter, produktionen av surfaktant i lungorna och fibrosutvecklingen hos djuren”, tillägger Pérez-Gil. ”I det här samarbetet tar vi på ett kombinerat sätt itu med effekterna på molekylär nivå, på telomerer, de biologiska och fysiska förändringarna i celler och vävnader och konsekvenserna för djurets hälsa, hela organismen.”
En terapi för alla typer av fibros
Under 2018 utvecklade CNIO-gruppen en genterapi som kunde bota den fibros som deras möss utvecklade utan genen för telomeras. Behandlingen bygger på att vända denna genetiska förändring och tillfälligt aktivera telomerassyntesen hos mössen.

Möss ges intravenöst ett virus vars enda funktion är att föra telomerasgenen till vävnaderna. Effekten är kortvarig, men den är tillräcklig för att få pneumocyter av typ II att återfödas med långa telomerer och för att lungvävnad ska återbildas.
Nu har de tillämpat samma behandling på möss som bara åldras. Och det fungerar också. ”Behandling med telomerasaktiverande genterapi förhindrade uppkomsten av fibros hos alla möss, även de som inte hade någon genetisk förändring men åldrades fysiologiskt”, förklarar Blasco.
Detta utvidgar möjligheten att bota lungfibros till att omfatta nästan alla fall av fibros, vilket forskarna konstaterar i sin artikel: ”Dessa fynd bidrar till att förklara betydelsen av telomeras för framtida behandlingsstrategier mot idiopatisk lungfibros.
Studien finansierades av det spanska ministeriet för vetenskap, innovation och universitet, Carlos III-institutet för hälsa, Madrid, Botín-stiftelsen och Banco Santander genom Santander Universities och World Cancer Research.
Studien finansierades av det spanska ministeriet för vetenskap, innovation och universitet, Carlos III-institutet för hälsa, Madrid, Botín-stiftelsen och Banco Santander genom Santander Universities och World Cancer Research.




