Enzymhämning
Enzymer behövs för de flesta, om inte alla, processer som krävs för livet. Enzymer katalyserar en reaktion genom att minska den aktiveringsenergi som krävs för att reaktionen ska inträffa. Enzymer måste dock regleras noggrant för att se till att nivåerna av produkten inte stiger till oönskade nivåer. Detta åstadkoms genom enzymhämning.
Typer av hämning
Reversibla och irreversibla hämmare är kemikalier som binder till ett enzym för att undertrycka dess aktivitet. En metod för att åstadkomma detta är att nästan permanent binda till ett enzym. Dessa typer av hämmare kallas irreversibla. Andra kemikalier kan dock tillfälligt binda till ett enzym. Dessa kallas reversibla. Reversibla hämmare binder antingen till en aktiv plats (kompetitiva hämmare) eller till en annan plats på enzymet (icke-kompetitiva hämmare).
 Fig 1 – Diagram för att visa effekten av kompetitiva och icke-kompetitiva enzymhämmare.
Fig 1 – Diagram för att visa effekten av kompetitiva och icke-kompetitiva enzymhämmare.Kompetitiva hämmare
Kompetitiva hämmare konkurrerar med substratet vid den aktiva platsen, och ökar därför Km (Michaelis-Menten-konstanten). Vmax är dock oförändrad eftersom reaktionen fortfarande kan slutföras med tillräcklig substratkoncentration. Diagrammet för enzymaktivitet mot substratkoncentrationen skulle förskjutas till höger på grund av ökningen av Km, medan Lineweaver-Burke-ritningen skulle vara brantare jämfört med utan hämmare.
Non-kompetitiva hämmare
Non-kompetitiva hämmare binder sig till en annan plats på enzymet och minskar på så sätt VMAX. KM är dock oförändrad. Detta visas genom ett lägre maximum på en graf som visar enzymaktiviteten mot substratkoncentrationen och ett högre y-intercept på en Lineweaver-Burke-plott jämfört med ingen hämmare.
| Kompetitiv | Intekompetitiv | |
| Var verkar den? | Aktiv plats | Alternativ plats |
| Förändring av km | Ökning | Oförändrat |
| Förändring av Vmax | Oförändrat | Minskning |
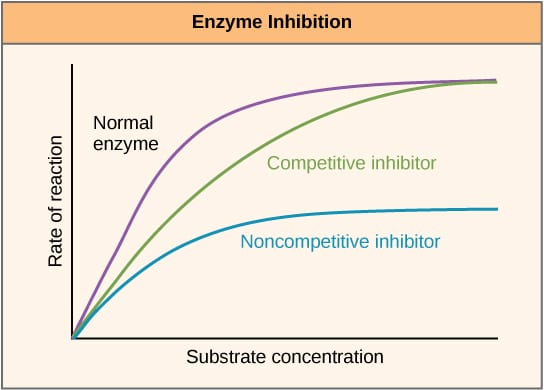 Fig 2 – Diagram som visar effekten av enzymhämmare på reaktionshastigheten och hur den varierar med substratkoncentrationen.
Fig 2 – Diagram som visar effekten av enzymhämmare på reaktionshastigheten och hur den varierar med substratkoncentrationen.Allosterisk hämning
Allosteriska enzymer uppvisar en sigmoidal kurva i motsats till den hyperboliska kurva som Michaelis-Menten-enzymer uppvisar. Detta beror på att de flesta allosteriska enzymer innehåller flera underenheter som kan påverka varandra när substratet binder till enzymet. Hämning kan påverka antingen K0,5, som är substratkoncentrationen för halvmättnad, Vmax eller båda. Detta resulterar i en förskjutning av kurvan till höger, och i fallet med minskning av Vmax förskjuts kurvan nedåt.
Allosteriska enzymer har två tillstånd: ett tillstånd med låg affinitet som kallas ”T”-tillståndet och ett tillstånd med hög affinitet ”R”-tillståndet. Inhibitorer fungerar genom att företrädesvis binda till T-tillståndet hos ett allosteriskt enzym, vilket får enzymet att bibehålla detta låga affinitetstillstånd.
Detta är ytterst användbart för att begränsa mängden av ett enzyms produkt, eftersom produkten sedan kan fortsätta att hämma samma typ av enzym för att se till att produktmängden inte blir för stor. Detta kallas återkopplingshämning. Till exempel hämmar ATP allosteriskt pyruvatkinas för att förhindra ökad bildning av pyruvat, så att mindre ATP slutligen bildas. Dessutom hämmas fosfofruktokinas allosteriskt av citrat, en mellanprodukt i Kreb-cykeln. Detta innebär att glykolysen kommer att begränsas när det sker en hög ATP-bildning från Krebs cykel.
 Fig 3 – Diagram för att visa mekanismen för både allosterisk hämning och aktivering.
Fig 3 – Diagram för att visa mekanismen för både allosterisk hämning och aktivering.Fosforylering
Fosforylering ger en annan mekanism genom vilken enzymer kan hämmas. Detta sker vanligtvis genom verkan av kinasenzymer, som antingen kan hämma eller aktivera ett enzym beroende på situationen. Kinasenzymerna klyver en fosfatgrupp från ATP och binder den till enzymet. I situationer där detta resulterar i en ökning av enzymaktiviteten skapas en kaskadreaktion, vilket gör att ett stort svar kan genereras från ett litet stimulus.
Zymogener
Enzymer kan också utsöndras i ett inaktivt tillstånd, vilket kallas zymogener. Zymogener är en användbar mekanism som gör att enzymer kan transporteras säkert till olika platser, utan att enzymet blir aktivt och utför sin funktion på vägen. De förblir inaktiva på grund av ett tillägg av aminosyror i proteinet. För att aktivera en zymogen måste därför ett annat enzym klyva bort dessa extra aminosyror. Chymotrypsinogen syntetiseras till exempel av bukspottkörteln, men är inaktiverat och kan inte fungera. När det kommer till tarmarna klyver ett annat enzym (trypsin) de extra aminosyrorna för att producera den aktiverade formen, chymotrypsin.
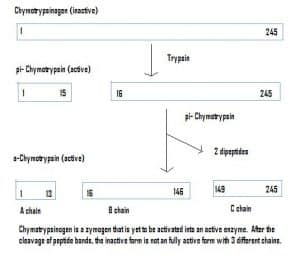 Fig 4 – Diagram som visar aktiveringen av chymotrypsinogen i mag-tarmsystemet och de enzymer som är inblandade i varje skede.
Fig 4 – Diagram som visar aktiveringen av chymotrypsinogen i mag-tarmsystemet och de enzymer som är inblandade i varje skede.Klinisk relevans – Farmakokinetik
Den viktigaste kliniska användningen av enzymhämning är användningen av farmaceutiska läkemedel. ACE-hämmare är en vanlig behandling av högt blodtryck. Angiotensin I omvandlas till angiotensin II genom verkan av Angiotensin Converting Enzyme (ACE). Angiotensin II orsakar dock många effekter som har att göra med en ökning av blodtrycket. Därför har ACE-hämmare utformats för att konkurrerande hämma ACE:s verkan, vilket resulterar i mindre bildning av angiotensin II och lägre blodtryck.
Alternativt binder penicillin irreversibelt till den aktiva platsen hos ett enzym som kallas DD-transpeptidas. DD-transpeptidas ansvarar för det sista steget i syntesen av bakteriernas cellväggar. Genom att hämma detta enzym kan bakterierna inte syntetisera en cellvägg och kan därför inte upprätthålla liv.
Till sist är cyanid ett exempel på en icke-kompetitiv hämmare. Cyanid binder sig till det sista enzymet i elektrontransportkedjan och hindrar detta enzym från att katalysera reaktionen från syre till vatten. Detta förhindrar flödet av elektroner nedåt i elektrontransportkedjan och inget ATP kan genereras, vilket leder till döden.




