Frontiers in Neuroscience
Introduktion
Genereringen av nya neuroner i den vuxna hippocampus, en region i hjärnan som är involverad i rumslig navigering och minnesbildning (Buzsaki och Moser, 2013), är en slående form av plasticitet som kvarstår under hela livet hos flera arter, inklusive människor (Altman och Das, 1965; Eriksson et al., 1998; Moreno-Jiménez et al., 2019). Bland de många förhållanden som reglerar den vuxna hippocampala neurogenesen är en av de mest tillförlitliga processerna som har beskrivits i stor utsträckning den åldersmedierade minskningen av neuronproduktionen, medan redan existerande neuronala populationer förblir konstanta med normalt åldrande (Kuhn et al., 1996; Kempermann et al., 1998; Burke och Barnes, 2010). Åldrandet påverkar många funktioner i hjärnan, inklusive synaptisk överföring och plasticitet, som tros bidra till minnesförlust (Burke och Barnes, 2006; Fan et al., 2017). Med tanke på att hippocampus är särskilt sårbar för åldersrelaterade förändringar och neurodegeneration blir det relevant att hitta strategier för att öka plasticiteten i denna struktur för att förebygga eller lindra effekterna av senescens (Bartsch och Wulff, 2015). Fysisk träning och kognitiva stimuli förbättrar hjärnans hälsa och tenderar att lindra effekterna av åldrande. En av de direkta fördelarna kan härröra från den aktivitetsberoende ökningen av nivåerna av hjärnavledd neurotrofisk faktor (BDNF), som har visat sig återställa synaptisk plasticitet, öka neurogenesen och förbättra inlärningen hos medelålders möss (Marlatt et al., 2012; Trinchero et al., 2017). Träning minskar också mikroglia-aktivering, ökar aktivitetsberoende synaptisk plasticitet, proliferation av neurala progenitorceller och påskyndar utveckling och integration av vuxenfödda granuleceller (GC) i den åldrande hippocampus (van Praag et al., 2005; Kronenberg et al., 2006; O’Callaghan et al., 2009; Marlatt et al., 2012; Gebara et al., 2013). Dessa effekter bidrar till att återställa hippocampusberoende plasticitet och korrelerar med adaptivt beteende. Således förbättrar åldrade djur som presterar dåligt i uppgifter om rumslig inlärning och mönsterseparation sina prestationer efter träning (van Praag et al., 2005; Marlatt et al., 2012; Wu et al., 2015; Duzel et al., 2016; Xu et al., 2017).
I vilken utsträckning neurogenes bidrar till de positiva beteendeeffekterna av träning hos åldrande djur är fortfarande under utredning. Det är möjligt att den ökning av neurogenesens hastighet som utövas av fysisk träning bidrar till beteendeförbättring. Men andra mekanismer kan också vara inblandade (Meshi et al., 2006). Den snabbare integrationen av nya neuroner i den åldrande dentate gyrus efter träning, som ändrar kvaliteten på nya GCs, kan också bidra till beteendeförbättring. Medan neuroner som föds hos medelålders möss utvecklas långsamt, främjar ihållande frivillig träning dendritisk tillväxt, ryggmärgsbildning och neuronal integration (Trinchero et al., 2017). Liknande effekter observerades av korta exponeringar för miljöberikning (EE) (Trinchero et al., 2019). Om den ackumuleras över flera neuronala kohorter kan den accelererade neuronala integrationen som utlöses av träning utöva betydande inflytande på hippocampusberoende inlärning och beteende. I detta arbete visar vi att flera kohorter av nya GCs snabbt kan integreras i de redan existerande kretsarna hos möss som fortsätter att engagera sig i frivillig löpning, och att dessa effekter kvarstår när mössen har slutat springa.
Material och metoder
Möss och kirurgi
C57BL/6J-hanmöss hölls med 4-5 djur per bur under standardförhållanden. Åtta månader gamla (8M) möss valdes ut eftersom det efter denna ålder sker en stark nedgång i hippocampal neurogenes som utesluter studier av märkta neuroner (Morgenstern et al., 2008; Trinchero et al., 2017). Möss sövdes (150 μg ketamin/15 μg xylazin i 10 μl saltlösning/g) och retrovirus infunderades i den septala regionen av höger dentate gyrus (1,5 μl vid 0,15 μl/min) med hjälp av sterila kalibrerade mikrokapillärpipetter genom stereotaktisk kirurgi; koordinater från bregma (i mm): -2 anteroposterior, -1,5 lateral och -1,9 ventral. Vid de angivna tidpunkterna fixerades hjärnorna och sektioner förbereddes för konfokal avbildning (Trinchero et al., 2017). Endast GC:er från den septala dentate gyrus inkluderades i analysen, vilket motsvarar sektioner lokaliserade från -0,96 till -2,30 mm från bregma, enligt atlasen för mushjärnan (Paxinos och Franklin, 2001). Försöksprotokollen godkändes av Institutional Animal Care and Use Committee of Fundación Instituto Leloir, i enlighet med principerna för biomedicinsk forskning som involverar djur från Council for International Organizations for Medical Sciences och de bestämmelser som anges i Guide for the Care and Use of Laboratory Animals.
Löpning
Löpsträckor registrerades för varje försök med hjälp av trådlösa löphjul. I försöken i figur 1 inhystes djuren med ett löphjul i 7 eller 21 dagar, enligt vad som anges. I detta tillstånd sprang mössen ∼2 km/dag. I figur 2, 3 där möss sprang i 1, 2 eller 3 månader var den övervakade sträckan ∼10 km/dag.
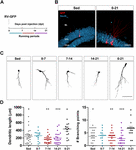
Figur 1. Långa men inte korta perioder av löpning påskyndar den morfologiska mognaden av nya GC:er. (A) Experimentell utformning. RV-GFP-injektion följdes av exponering för 1 veckas frivillig löpning vid de angivna fönstren eller under hela experimentet (0-21 dpi). (B) Representativa bilder av 21 dpi GCs som uttrycker GFP (rött) tagna från stillasittande och 0-21 löpargrupper. NeuN (blått) markerar granulecellskiktet (GCL) (ML, molekylärt skikt). Skala, 50 μm. (C) Representativa konfokala bilder av 21-dpi GFP-GCs för de olika grupperna. Skala, 50 μm. (D) Dendritisk komplexitet (längd och förgreningspunkter) för de olika löpande fönstren. ∗, ∗∗∗ och ∗∗∗ betecknar p < 0,05, p < 0,01 och p < 0,001 jämfört med gruppen med 0-21 löpning efter Kruskal-Wallis-test följt av Dunns post hoc-test. Inga skillnader hittades mellan någon av grupperna som sprang i 7 dagar. Provstorlekar (neuroner/möss): 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21) och 15/3 (0-21). Horisontella staplar anger medelvärde ± SEM. Öppna cirklar motsvarar exempelneuroner.
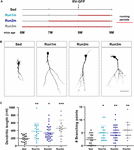
Figur 2. Effekter av löpning på olika neuronala kohorter. (A) Experimentell utformning. RV-GFP-injektion följdes av 3 veckors löpning och föregicks av stillasittande förhållanden (Run1m), 1 (Run2m) eller 2 månaders löpning (Run3m). Alla grupper jämfördes med stillasittande möss (Sed). Den totala dendritiska längden analyserades vid 21 dpi. (B) Representativa konfokala bilder GFP-GCs. Skalstreck, 50 μm. (C) Dendritisk komplexitet (längd och förgreningspunkter) för de olika fönstren av löpning. ∗, ∗∗∗ och ∗∗∗ betecknar p < 0,05, p < 0,01 och p < 0,001 jämfört med Sed efter Kruskal-Wallis-test följt av Dunns post hoc-test. Provstorlekar (neuroner/möss): 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m) och 15/3 (Run3m). Horisontella staplar anger medelvärde ± SEM. Öppna cirklar motsvarar exempelneuroner.

Figur 3. Bestående effekter av kronisk träning. (A) Experimentell utformning. RV-GFP-injektion följdes av 3 veckors löpning (Run1m) eller föregicks av 1 månads träning (Run-1m) eller 1 månads träning och 1 månad utan löphjul (Run-2m). Alla grupper jämfördes med stillasittande möss (Sed). Den totala dendritiska längden analyserades vid 21 dpi. (B) Representativa konfokala bilder av märkta GCs. Skalstreck, 50 μm. (C) Dendritisk komplexitet (längd och förgreningspunkter) för de olika löpfönstren. ∗∗∗∗ anger p < 0,001 jämfört med Sed efter Kruskal-Wallis-test följt av Dunns post hoc-test. Provstorlekar (neuroner/möss): 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m) och 18/3 (Run-2m). (D) MFB-morfologi i CA3 analyserades för Run1m- och Run-1m-grupperna och jämfördes med Sed. Representativa konfokala bilder. Skalstreck, 5 μm. (E) ∗ och ∗∗∗ anger p < 0,05 och p < 0,01 efter Kruskal-Wallis-test följt av Dunns post hoc-test. Provstorlekar: 27/4 (Sed), 32/4 (Run1m) och 18/4 (Run-1m). Horisontella staplar anger medelvärde ± SEM. Öppna cirklar motsvarar exempel boutons.
Immunofluorescens
Immunfärgning gjordes på 60-μm fritt flytande koronala sektioner. Antikropparna applicerades i trisbuffrad saltlösning (TBS) med 3 % donkey serum och 0,25 % Triton X-100. Immunofluorescens utfördes med anti GFP (kaninpolyklonalt; 1:500; Invitrogen), anti NeuN (musmonoklonalt; 1:50; en gåva från F.H. Gage, Salk Institute for Biological Studies, La Jolla, CA, USA), antikroppar mot åsne-antikanin Cy3 och åsne-antikantikmus Cy5 (1:250; Jackson Immuno Research Laboratories).
Konfokal mikroskopi
För dendritiska längdmätningar togs bilder (40×; NA 1,3; oljeimpregnering) från 60-μm tjocka sektioner genom att ta Z-staplar som inkluderar 35-50 optiska skivor, airy unit = 1 med 0,8-μm mellanrum (Trinchero et al, 2017). Dendritisk längd mättes sedan med hjälp av programvaran LSM Image Browser från projektioner av tredimensionella rekonstruktioner på ett enda plan i GCs som uttrycker GFP. Bilder av GFP-märkta MFB:er i CA3-regionen togs med 0,4 μm intervall (63×; NA 1,4; oljeimpregnering) och en digital zoom på 6. Area och antal filopoder analyserades från projektioner av tredimensionella rekonstruktioner på ett enda plan. Mossy fiber boutons (MFB) som uppfyllde följande kriterier valdes ut för kvantifiering: (i) Boutonens diameter var >tre gånger större än fiberns diameter, (ii) Boutonen var ansluten till den mossiga fibern i minst en ände (Toni et al., 2008). Filopodier identifierades som utsprång som uppstår från stora mossiga terminaler (1 μm < längd < 20 μm) (Acsady et al., 1998). Filopodialförlängningar mättes genom att räkna antalet protrusioner per terminal. För bildtagning och analys av morfologiska egenskaper var alla undersökta experimentella grupper blinda för operatören.
Statistisk analys
Om inte annat anges presenteras data som medelvärde ± SEM. Normaliteten bedömdes med hjälp av Shapiro-Wilks test, D’Agostino-Pearson omnibus test och Kolmogorov-Smirnov test, med ett p-värde på 0,05. När data uppfyllde normalitetstesterna (Gaussisk fördelning och lika varians) användes opartade t-test med Welch-korrigering eller ANOVA med Bonferronis post hoc-test enligt vad som anges. I de fall som inte uppfyllde kraven på normalitet användes icke-parametriska tester enligt följande: Mann-Whitneys test för oberoende jämförelser och Kruskal-Wallis test för multipla jämförelser.
Resultat
Vi har tidigare visat att löpning påskyndar utvecklingen och den funktionella integrationen av nya GCs i den åldrande hippocampus (Trinchero et al., 2017). Vi undersökte nu om denna typ av plasticitet kräver en ihållande aktivitetsnivå som ackumuleras med tiden, eller om kortare perioder av löpning också kan utlösa snabbare integration, vilket tidigare observerats för exponering för EE (Trinchero et al., 2019). För att besvara denna fråga märktes nya neuronala kohorter i medelålders möss (8 månaders ålder; 8M) med hjälp av ett retrovirus som uttrycker GFP (RV-GFP). Mössen fick använda ett löphjul i 1 vecka inom olika fönster av neuronal utveckling, eller springa under hela intervallet av neuronal tillväxt (3 veckor; figurerna 1A, B). Som tidigare beskrivits uppvisade nya GC en långsam utveckling hos stillasittande möss, vilket resulterade i korta dendriter med små förgreningar vid 3 veckor. En veckas löpning förändrade inte det allmänna utseendet hos nya GC:er i något av de testade intervallen (figurerna 1C,D). Däremot resulterade löpning under hela 3-veckorsintervallet i ökad dendritisk längd och förgrening, vilket stämmer överens med en accelererad neuronal integration.
De observerade effekterna av träning testades på en enda neuronal kohort, den som var retroviralt märkt. Eftersom nya GC:er kontinuerligt genereras är det dock tänkbart att GC:er som föds vid olika tillfällen under träningsperioden också kan påverkas av aktiviteten. För att testa denna hypotes använde vi en enkel strategi för att märka neuronala kohorter som föddes vid olika tidpunkter med avseende på träningsinitiering genom att utsätta möss för löphjul i olika intervaller, men alltid analysera neuronal struktur 3 veckor efter retroviral injektion (för enkelhetens skull benämnd 1m). Tre kohorter jämfördes således; en som sprang i 3 veckor, märkt direkt vid träningsstart (Run1m), en som sprang i 2 månader, märkt 1 månad efter träningsstart (Run2m) och en som sprang 3 månader, märkt 2 månader efter träningsstart (Run3m) (figur 2A). Vi observerade en liknande grad av neuronal tillväxt i alla förhållanden jämfört med stillasittande möss, vilket tyder på att alla neuronala kohorter som föds i hjärnan hos en medelålders mus som utför frivillig löpning kommer att genomgå snabb tillväxt och integration (figurerna 2B,C). Dendritiska träd av GC:er i Run3m-möss var något längre än de från Run1m- eller Run2m-möss, vilket tyder på att främjandet av neuronal integration kan svara på en mekanism vars effekt ackumuleras med tiden. Ändå resulterade 1 månads löpning i en nästan maximal effekt på GC-utvecklingen.
Vi undersökte sedan effekterna av träning i den åldrande hjärnan på neuronala kohorter som föddes när aktiviteten upphörde. Vi jämförde hur löpning i 3-4 veckor påverkar utvecklingen av nya GC som föds direkt i början (Run1m), i slutet (Run-1m) eller 1 månad efter träningens slut (Run-2m; figur 3A). Överraskande nog reagerade neuronala kohorter som föddes i början eller i slutet av löparperioden på liknande sätt (figurerna 3B, C). Däremot visade kohorter födda 1 månad efter träningens slut (Run-2m) endast en subtil effekt.
För att integreras fullt ut i kretsen etablerar GCs glutamatergiska excitatoriska kopplingar till CA3-pyramidala celler genom stora MFBs, och rekryterar GABAergisk feedforward-hämning på pyramidala celler via filopodialförlängningar som uppstår från dessa terminaler (Acsady et al, 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Medan konfokalanalysen inte avslöjade några förändringar i arean av MFBs hos neuroner födda vid Run-1m eller Run1m jämfört med kontroller, ökade antalet filopoder/MFBs med ∼100 % (figurerna 3D,E). Dessa resultat tyder på att fysisk träning specifikt ökar konnektiviteten från nya GCs till det hämmande lokala nätverket (Trinchero et al., 2019).
Diskussion
Vuxen neurogenes involverar en sekvens av komplexa utvecklingssteg som resulterar i integrationen av nya informationsbearbetande enheter. Neurala stamceller i den subgranulära zonen lämnar sitt lugna tillstånd för att bli prolifererande neurala progenitorceller som utökar prekursorpopulationen (transit amplifying cells) (Bonaguidi et al., 2012). Progenitorcellerna genererar neuroner som migrerar, utvecklas och integreras i kretsen. Under detta förlängda tidsfönster sker en markant minskning av neuronalpoolen på grund av apoptotisk celldöd. Frivillig träning och EE utgör starka stimuli för att öka den vuxna hippocampala neurogenesen hos gnagare under hela livet (van Praag et al., 1999a, b; Kronenberg et al., 2003, 2006; Wu et al., 2008; Kannangara et al., 2011). Neurogenesen minskar i den åldrande hjärnan, huvudsakligen som en följd av minskningen av storleken på progenitorcellpoolen. Både löpning och EE kan motverka den minskade neuronala produktionen som rapporterats hos åldrande djur, och verkar genom olika mekanismer (Kempermann et al., 2010). Löpning verkar på två nivåer för att öka neurogenesen: öka spridningshastigheten för neurala progenitorceller (van Praag et al., 1999b, 2005; Cooper et al., 2018) och påskynda mognaden och den funktionella integrationen av neuroner som utvecklas (Trinchero et al., 2017). EE ökar överlevnaden och påskyndar även mognaden av nya GC, men påverkar inte proliferationen (Trinchero et al., 2017, 2019).
Löpning främjar även omkoppling av neuronala konnektiviteter och modulering av inneboende egenskaper i nya GC under den första utvecklingsveckan hos unga vuxna möss (Sah et al., 2017). Vi har nyligen rapporterat en kritisk period under den andra veckan av GCs mognad hos åldrande djur, där EE inducerar dendritisk tillväxt och snabbare integrering av nya neuroner i kretsen (Trinchero et al., 2019). Vi frågade här om löpning i 1 vecka vid någon tidpunkt av GCs utveckling skulle påverka deras integration, men fann ingen effekt (figur 1). Hela löpperioden på 3 veckor krävdes för att reglera neurogenesen. Avsaknaden av kortsiktig modulering tyder på en mekanism som medieras av faktorer som måste byggas upp för att utöva märkbara förändringar. Intressant nog förvärrar frivillig träning produktionen av BDNF, som ackumuleras under flera veckor innan den når en platånivå som utövar maximal verkan (Vecchio et al., 2018). Även om neurotrofiner är nyckelmediatorer är det troligt att de effekter som observerats här förmedlas av flera mekanismer. Träning ökar också den elektriska aktiviteten i dentate gyrus, ökar blodflödet och modulerar neuroinflammation (Piatti et al., 2011; Speisman et al., 2013; Trinchero et al., 2017). Bidraget från andra mekanismer kräver ytterligare studier.
Vi visar här att ∼3 veckor gamla GC från åldrande möss som kroniskt utsätts för ett löpande hjul (upp till 3 månader) uppvisar en fullt utvecklad fenotyp med långa och komplexa dendritiska arboriseringar, som liknar dem hos nya GC som genereras hos unga vuxna möss (figur 2). Mogna GC:er i unga vuxna och medelålders möss uppnår likvärdig dendritisk längd och komplexitet i slutet av utvecklingen, jämförbara med tre veckor gamla GC:er i åldrande möss som utsätts för EE eller löpning (Piatti et al., 2011; Trinchero et al., 2017, 2019). Dessa samlade bevis talar för en tydlig acceleration av mognadshastigheten som framkallas av löpning.
På nivån för neuronal output främjade löpning den snabba tillväxten av filopodialförlängningar men ändrade inte storleken på MBF:er (figurerna 3D, E). Detta resultat tyder på att nya GC:er integreras snabbt, men att deras utgång kan vara förskjuten mot aktivering av GABAergiska interneuroner i CA3 (som kontaktas av filopodier), snarare än pyramidceller som kontaktas av MFB:er (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Det är förvånande att EE framkallade en markant ökning av både storleken på MFBs och antalet filopodialförlängningar hos åldrande möss, vilket är förenligt med en mer balanserad modulering av den neuronala produktionen (Trinchero et al., 2019). Vi spekulerar i att förändringar på grund av EE involverar aktivitetsberoende ommodellering av specifika synapser som blir förstärkta för kodning av rumsliga signaler (Nicoll och Schmitz, 2005; Holtmaat och Svoboda, 2009). Däremot kan löpning utgöra en allmän stimulans för nya GC:er att bli förberedda för att ansluta till specifika mål när kodning blir nödvändig, samtidigt som den inhiberande tonen från GABAergiska interneuroner bevaras, vilket kan fungera som en mekanism som begränsar den postsynaptiska aktiviteten tills den nya GC:en har monterats ordentligt i det omgivande nätverket.
Våra resultat tyder på att den åldrande hjärnan genererar neurogena signaler när möss fortsätter att springa under längre perioder (månader). I detta sammanhang kommer efterföljande neuronala kohorter som föds i löpande möss att utvecklas och integreras snabbt, vilket gör att åldrande kretsar kan ackumulera ett betydande antal nya neuroner (figur 4). Den kontinuerliga inkorporeringen av nya GC med egenskaper som liknar det som sker hos yngre möss resulterar i en föryngrad hippocampus med neuroner som skulle kunna vara förberedda för att reagera på framtida upplevelser.
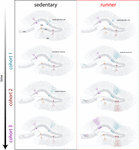
Figur 4. Löparinducerad föryngring av hippocampusnätverket hos medelålders möss. Schematisk representation av tidsförloppet för neuronal integration hos stillasittande (vänster) och löpande (höger) möss efter långvariga intervaller av frivillig träning. I den subgranulära zonen i gyrus dentata är radial-glia-liknande celler (RGL) fortfarande i ett lugnt tillstånd (överst). Stillasittande åldrande möss uppvisar låga nivåer av neurogenes och nya neuroner utvecklas långsamt (representativa kohorter anges med olika färger). Hos löpande möss ökar produktionen av nya GCs, och dessa nya enheter utvecklas och integreras snabbare, vilket expanderar det neurala nätverket på ett kumulativt sätt över en längre tidsperiod. I slutändan blir dessa nya kohorter av fullt mogna neuroner engagerade för att bearbeta information på begäran.
Från ett bredare perspektiv åtföljs den ökade livslängd som är förknippad med det moderna samhället av en högre risk för kognitiv nedgång. Därför blir det relevant att förstå de mekanismer som ligger till grund för de välkända fördelarna med motion för hjärnans funktion. Dessutom kan det finnas långsiktiga skillnader mellan individer som tränar motion under olika intervaller i livet och de som har tränat kontinuerligt, när det gäller att minska risken för att utveckla neurodegenerativa sjukdomar (Llorens-Martin, 2018). Våra resultat visar att kontinuerlig löpning främjar integrationen av många neuronala kohorter, vilket höjer nätverkets komplexitet på ett anmärkningsvärt sätt. Att utforma olika strategier för att öka effektiviteten av integrationen av nya neuroner i hippocampus kan fungera som en lovande mekanism för plasticitet för att så småningom förbättra den kognitiva nedgång som sker i den friska och sjuka åldrande hjärnan. Slutligen kommer dissekering av de mekanismer som ligger till grund för de olika aspekterna av sådan accelererad neuronal integration och utveckling att lära oss mycket om potentialen för plasticitet hos neurala nätverk i den åldrande hjärnan.
Data Tillgänglighet
Data som stödjer resultaten av denna studie är tillgängliga från motsvarande författare på rimlig begäran.
Etiskt uttalande
Djurstudien granskades och godkändes av kommittén för användning och skötsel av försöksdjur vid Leloirinstitutet.
Författarens bidrag
MT och MH utförde experimenten och analyserade data. MT, MH och AS utformade experimenten och skrev manuskriptet. AS gav finansiellt stöd.
Finansiering
Detta arbete stöddes av den argentinska myndigheten för främjande av vetenskap och teknik (Grant# PICT2015-3814), National Institute of Neurological Disorders and Stroke och Fogarty International Center (Grant# R01NS103758) till AS, som är utredare i Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). MT fick stöd av ett CONICET-stipendium.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
Vi tackar medlemmarna i AS labb för insiktsfulla diskussioner.
Acsady, L., Kamondi, A., Sik, A., Freund, T. och Buzsaki, G. (1998). GABAergic cells are the major postsynaptic targets of mossy fibers in the rat hippocampus. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., and Das, G. D. (1965). Autoradiografiska och histologiska bevis för postnatal hippocampal neurogenes hos råttor. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T. och Wulff, P. (2015). Hippocampus vid åldrande och sjukdom: från plasticitet till sårbarhet. Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L. och Song, H. (2012). En förenande hypotes om däggdjurs neurala stamcellsegenskaper i den vuxna hippocampus. Curr. Opin. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., and Barnes, C. A. (2006). Neuronal plasticitet i den åldrande hjärnan. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., and Barnes, C. A. (2010). Senescent synapses and hippocampal circuit dynamics. Trends Neurosci. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., and Moser, E. I. (2013). Minne, navigering och thetarytm i det hippocampala-entorhinala systemet. Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., and van Praag, H. (2018). På jakt efter hippocampal plasticitet. Cold Spring Harb. Perspect. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H. och Sendtner, M. (2016). Kan fysisk träning på äldre dagar förbättra minnet och hippocampusfunktionen? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., et al. (1998). Neurogenes i den vuxna människans hippocampus. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., and Villeda, S. A. (2017). Mekanismer för hippocampus åldrande och potentialen för föryngring. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J. och Toni, N. (2013). Vuxen hippocampal neurogenes korrelerar omvänt med mikroglia i förhållanden av frivillig löpning och åldrande. Front. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A. och Svoboda, K. (2009). Erfarenhetsberoende strukturell synaptisk plasticitet i däggdjurshjärnan. Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R., et al. (2011). Löpning minskar stress och förbättrar cellgenesen hos åldrade möss. Neurobiol. Aging 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. (2010). Varför och hur fysisk aktivitet främjar erfarenhetsinducerad hjärnplasticitet. Front. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., and Gage, F. H. (1998). Erfarenhetsinducerad neurogenes i den senescenta dentate gyrus. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D. och Kempermann, G. (2006). Fysisk träning förhindrar åldersrelaterad nedgång i prekursorcellsaktivitet i musens dentata gyrus. Neurobiol. Aging 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. (2003). Subpopulationer av prolifererande celler i den vuxna hippocampus reagerar olika på fysiologiska neurogena stimuli. J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H. och Gage, F. H. (1996). Neurogenes i dentate gyrus hos den vuxna råttan: åldersrelaterad minskning av neuronal progenitorproliferation. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Träning av nya neuroner för att besegra Alzheimers sjukdom. Brain Plast. 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J. och van Praag, H. (2012). Löpning under hela medelåldern förbättrar minnesfunktion, hippocampal neurogenes och BDNF-nivåer hos kvinnliga C57BL/6J-möss. Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. (2006). Hippocampal neurogenes krävs inte för beteendeeffekter av miljöberikning. Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., et al. (2019). Vuxen hippocampal neurogenes är riklig hos neurologiskt friska personer och minskar kraftigt hos patienter med Alzheimers sjukdom. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G. och Schinder, A. F. (2008). Nyfödda granuleceller i den åldrande dentate gyrus. J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., and Schmitz, D. (2005). Synaptisk plasticitet vid hippocampala mossy fiber synapser. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., and Kelly, A. M. (2009). Långvarig löpbandsexponering skyddar mot åldersrelaterade neurodegenerativa förändringar i råttans hippocampus. Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | CrossRef Full Text | Google Scholar
Paxinos, G., and Franklin, K. B. J. (2001). Mushjärnan i stereotaxiska koordinater. Amsterdam: Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F. och Schinder, A. F. (2011). Tidpunkten för neuronal mognad i den vuxna hippocampus moduleras av lokal nätverksaktivitet. J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A. och Frankland, P. W. (2015). Utveckling av vuxengenererade cellkonnektivitet med excitatoriska och inhiberande cellpopulationer i hippocampus. J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C. och van Praag, H. (2017). Löpning omorganiserar kretsarna hos en vecka gamla vuxenfödda hippocampala neuroner. Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Foster, T. C. och Ormerod, B. K. (2013). Daglig motion förbättrar minnet, stimulerar hippocampal neurogenes och modulerar immun- och neuroimmuna cytokiner hos åldrande råttor. Brain Behav. Immun. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. (2013). Sömlös rekonstruktion av intakta vuxenfödda neuroner med hjälp av seriell slutblocksavbildning avslöjar komplex axonstyrning och utveckling i den vuxna hippocampus. J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. (2008). Neuroner som föds i den vuxna dentata gyrus bildar funktionella synapser med målceller. Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C., et al. (2017). Hög plasticitet hos nya granuleceller i den åldrande hippocampus. Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C., and Schinder, A. F. (2019). Erfarenhetsberoende strukturell plasticitet hos vuxenfödda neuroner i den åldrande hippocampus. Front. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J. och Gage, F. H. (1999a). Löpning förbättrar neurogenes, inlärning och långtidspotentiering hos möss. Proc. Natl. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G. och Gage, F. H. (1999b). Löpning ökar cellproliferation och neurogenes i den vuxna musens dentate gyrus. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C. och Gage, F. H. (2005). Motion förbättrar inlärning och hippocampal neurogenes hos åldrade möss. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C. och Aubert, I. (2018). Träningens neuroprotektiva effekter: att bibehålla en frisk hjärna under hela åldrandet. Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y., et al. (2008). Träning ökar spridningen av neurala stamceller och neurittillväxt och överlevnad av neuronala progenitorceller i dentat gyrus hos medelålders möss. J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M. och Hen, R. (2015). Löpning räddar ett rädslobaserat kontextuellt diskrimineringsunderskott hos åldrade möss. Front. Syst. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). Löparinducerad minnesförbättring korrelerar med bevarandet av tunna taggar i hippocampusområdet CA1 hos gamla C57BL/6-möss. Neurobiol. Aging 52, 106-116. doi: 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar




