Frontiers in Oncology
Introduktion
Glioblastom och anaplastiskt astrocytom (ANA) är två av de vanligaste primära hjärntumörerna hos vuxna (1). Det finns en verklig ökning av incidensen, särskilt hos äldre personer (1-3). I klinisk praxis är det svårt att skilja patienter med glioblastom från patienter med ANA före operation eller biopsi, eftersom symtomen och tecknen på de två tumörerna är relativt enhetliga och ospecifika (4, 5). Hanteringen för dem är dock olika, t.ex. kemoterapiprotokoll, dosering och administreringssätt (6). För patienter med ANA (WHO-grad III) rekommenderas till exempel strålbehandling eller TMZ efter resektion eller biopsi, medan det för patienter som nyligen diagnostiserats med glioblastom (WHO-grad IV) är strålbehandling plus samtidig TMZ, följt av adjuvant TMZ. Enligt tidigare studier växer glioblastom och ANA genom invasion i normal hjärnvävnad, sprids genom cerebrospinalvätskan (CSF) och sträcker sig bortom en enda karotis- eller vertebralartärdistribution, vilket gör att de båda reagerar dåligt på medicinsk behandling och blir ledande orsaker till cancerrelaterad död hos vuxna (7, 8). Dessutom är prognosen för glioblastom och ANA olika. I den äldre befolkningen finns det ingen signifikant skillnad i prognos mellan glioblastom och ANA, men skillnaden kan finnas i den yngre befolkningen (9). Därför är det svårt men avgörande att skilja glioblastom från ANA.
Magnetic Resonance Imaging (MRI) är den optimala neuroimaging vid preoperativ diagnos av glioblastom och ANA på grund av dess multiplanära förmåga och överlägsna mjukdelskontrast. Även om vissa studier visade att närvaron av ringliknande förstärkning och nekros tyder på glioblastom, framstår i de flesta fall både glioblastom och ANA som oregelbundna former på MR-bilder (hyperdens på T2-viktad sekvens och hypodens på T1-viktad sekvens) med olika grad av Gd-baserad kontrastförstärkning och ödem, varav skillnaderna vanligen var omärkliga för det mänskliga ögat (10-12).
På senare tid har texturanalys (TA), även känd som radiomik, tillämpats i stor utsträckning inom olika områden. Forskare fann att TA var en genomförbar och lovande metod för att underlätta differentialdiagnostik, eftersom den möjliggjorde förvärv av ytterligare kvantitativ information från MR-bilder som var osynlig för mänsklig bedömning (13-15). TA beskriver frekvensfördelningen och den rumsliga organisationen av voxelvärdet för att avslöja eventuella skillnader i tumörvävnad (16). I tidigare studier har man undersökt möjligheten att tillämpa TA vid differentialdiagnostik, subtypklassificering av tumörer och upptäckt av heterogenitet i tumörvävnad (17-19). Till vår kännedom har tillämpningen av TA vid differentialdiagnostik mellan glioblastom och ANA ännu inte rapporterats. Syftet med den här studien var att utvärdera den diskriminerande förmågan hos MRI-texturanalys med hjälp av algoritmer för maskininlärning för att differentiera glioblastom och ANA.
Material och metoder
Patienturval
Vi sökte retrospektivt i vår institutions databas och screenade alla patienter som histopatologiskt diagnostiserats som glioblastom eller ANA, från januari 2015 till december 2018. Behörighetskriterier för kvalificerade patienter var: (1) slutgiltig histopatologisk diagnos av glioblastom eller ANA; (2) utarbetade elektroniska medicinska journaler, särskilt patologiskt material; (3) diagnostisk MR-skanning på vår institution före kirurgisk resektion. Uteslutningskriterier var: (1) historia av intrakraniell sjukdom (t.ex. hjärntrauma, intrakraniell infektion eller andra typer av hjärntumörer), med tanke på ärrvävnadens interferens på bildernas intensitet; (2) förekomst av rörelseartefakt på MR-undersökningen; (3) historia av behandlingar före MR-undersökningen (t.ex. kirurgi, kemoterapi eller strålbehandling); (4) patienter som inte uppnådde kriterierna för diagnosen glioblastom eller ANA enligt WHO:s klassificeringssystem från 2016. En senior neuropatolog med tio års erfarenhet bedömde om patienten uppfyllde kriterierna (WHO:s klassificeringssystem från 2016) för glioblastom eller ANA. Den institutionella granskningsnämnden godkände denna retrospektiva studie. Det skriftliga informerade samtycket inhämtades från de deltagare som deltog i studien. Den etiska kommittén vid Sichuan University och radiologiavdelningen vid vår institution har godkänt utnyttjandet av statistiken för denna studie.
MR Image Acquisition
För alla patienter som ingick i denna studie fanns kontrastförstärkta T1-viktade sekvenser tillgängliga och de erhölls på 3,0T Siemens Trio Scanner med följande parametrar: TR/TE/TI = 1900/2.26/900 ms, Flip-vinkel = 9 °, 20 axiella skikt med tjocklek = 5 mm, axiell FOV = 25,6 × 25,6 cm2 och datamatris = 256 × 256. Vid kontrastförstärkt T1-viktad avbildning användes gadopentetat dimeglumin (0,1 mmol/Kg) som kontrastmedel för kontrastförstärkt bild, och multidirektionella data för kontrastförstärkt MRT samlades in under den kontinuerliga intervalltiden 90-250 s.
Texturutvinning
I vår studie användes LifeX-paketet (http://www.lifexsoft.org) för att utvinna texturegenskaper. Postkontrast T1-viktade (T1C) bilder valdes ut för vidare analys på grund av den tydliga skildringen av tumörens läge och gräns (20). Region of interest (ROI) ritades manuellt skiva för skiva i axialplanet längs lesionerna på kontrastförstärkta bilder för att få fram texturfunktioner. Två erfarna neurokirurger, som var blinda för patienternas journaler och histopatologiska diagnoser, ritade ROI och redigerades sedan av en senior radiolog och en senior neurokirurg. Oenigheter behandlades genom diskussioner och samråd med den förste radiologen och den förste neurokirurgen. Sammanlagt 40 texturegenskaper extraherades från MRT-bilderna, inklusive minValue, meanValue, maxValue, stdValue och parametrar som härrör från sex matriser: Histogrambaserad matris (HISTO), Shape, Gray-level co-occurrence matrix (GLCM), Gray-level run length matrix (GLRLM), Gray-level zone length matrix (GLZLM) och Neighborhood gray-level dependence matrix (NGLDM).
Features Selection
Det fanns totalt 40 texturdetaljer som härrörde från sex utvalda matriser. Förklaringen till de 40 texturfunktionerna visas i kompletterande tabell 1. Statistiken för dessa texturdetaljer visas i tilläggstabell 2. Funktionsspecifika urvalet utfördes för att fastställa relevanta funktioner och därmed undvika överanpassning. Dessutom kunde den maskininlärningsalgoritm som tillämpades i den här studien inte ta med alla 40 texturfunktioner i analysen. Tre oberoende metoder för funktionsval användes för att välja optimala texturfunktioner, bland annat Distance Correlation, least absolute shrinkage, and selection operator (LASSO) och gradient correlation decision tree (GBDT). Tre delmängder av texturfunktioner bildades därmed och utgjorde tre olika dataset.
Klassificering
Linjär diskriminantanalys (LDA) är en robust klassificeringsmetod för att separera två klasser genom att söka efter den linjära kombinationen av prediktorer som maximerar separationen mellan grupperna. I den här studien upprättades tre klassificeringsmodeller baserade på LDA-algoritmen: I denna studie användes följande modeller: Distanskorrelation + LDA, LASSO + LDA och GBDT + LDA. Datamängderna matades in i LDA-algoritmen respektive oberoende av varandra. Varje dataset delades slumpmässigt upp i en tränings- och en valideringsgrupp i förhållandet 4:1. Den modell som tränades i träningsgruppen tillämpades sedan på den oberoende valideringsgruppen för att utvärdera dess prestanda. För att bedöma LDA-algoritmens robusthet upprepades förfarandet i 100 cykler med olika, slumpmässiga och oberoende falltilldelningar. En förvirringsmatris fastställdes med hjälp av den sanna tilldelningen från histopatologin och LDA-algoritmens förutsägelser. Standardkänslighet, specificitet, ytorna under den karakteristiska mottagarkurvan (AUC) och noggrannhet beräknades för både tränings- och valideringsgruppen för att avslöja modellernas diskriminerande förmåga. Jämförelsen av tre modeller (Distance Correlation + LDA, LASSO + LDA och GBDT + LDA) genomfördes för att fastställa den optimala diskriminerande modellen för glioblastom och ANA. Flödesschemat för MRI-klassificering med hjälp av texturfunktioner visas i figur 1.
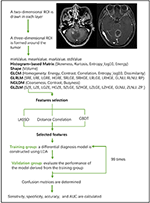
Figur 1. Flödesschema över MRI-klassificering med hjälp av texturfunktioner. ANA, anaplastiskt astrocytom; LDA, linjär diskriminantanalys; MRI, Magnetic Resonance Imaging; LASSO, least absolute shrinkage and selection operator; GBDT, gradient correlation decision tree; HISTO, histogram-based matrix; GLCM, Gray-level co-occurrence matrix; GLRLM, Gray-level run length matrix; GLZLM, Gray-level zone length matrix; NGLDM, Neighborhood gray-level dependence matrix; AUC, area under receiver operating characteristic curve.
Resultat
Patienternas egenskaper
Totalt 133 patienter med glioblastom (n = 76) eller ANA (n = 57) uppfyllde inklusionskriterierna. Alla patienter med glioblastom ingick i studien, medan 10 patienter med ANA uteslöts enligt uteslutningskriterierna. Slutligen ingick 76 patienter med glioblastom och 46 patienter med ANA i denna studie. Patienternas medelålder var 46,9 (15-67) respektive 40,0 (7-69). Alla patienter genomgick kirurgiskt tumörresektion på vår neurokirurgiska avdelning från 2015 till 2018. Figur 2 visar två fall av det axiella planet av kontrastförstärkta bilder hos patienter med glioblastom och ANA.
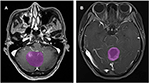
Figur 2. Exempel på två fall från kontrastförstärkta MR-bilder hos patienter med glioblastom och ANA. (A) Kontrastförstärkta bilder med ANA, (B) kontrastförstärkta bilder med glioblastom. ANA, Anaplastic astrocytoma.
Glioblastom vs ANA
Det fanns tre modeller som analyserades i den här studien, inklusive Distance Correlation + LDA, LASSO + LDA, GBDT + LDA. De texturfunktioner som användes för klassificering i dessa modeller visas i kompletterande tabell 3. Prestandan för varje modell presenterades i tabell 1 (inklusive känslighet, specificitet, noggrannhet och AUC för tränings- och valideringsgruppen). LASSO + LDA uppnådde den bästa prestandan med de högsta AUC:erna i både tränings- och valideringsgruppen. Känsligheten, specificiteten, noggrannheten och AUC för träningsgruppen var 0,989, 0,993, 0,996 respektive 0,997, och för valideringsgruppen var de 0,927, 0,989, 0,968 respektive 0,974. Dessutom visade Distance Correlation + LDA och GBDT + LDA också lovande förmåga att särskilja glioblastom från ANA, med AUC ≥0,95 för både träningsgrupper och valideringsgrupper.

Tabell 1. Diskriminering mellan glioblastom och ANA.
Figur 3 visar förhållandet mellan de kanoniska diskriminerande funktionerna från LASSO + LDA-modellerna för glioblastom- och ANA-grupperna (trianglar och cirklar) och för gruppcentroiderna (kvadrater). Minimal överlappning observerades i denna figur. Kvalitativt sett kunde analysen av de data som valts ut av LASSO skilja glioblastom från ANA. Figur 4 visar fördelningen av den direkta LDA-funktionen som bestämts för glioblastom och ANA för en av de 100 oberoende träningscyklerna i dataanalysen för att illustrera prestandan hos LASSO + LDA-modellen. Det fanns tydliga förskjutningar av LDA-funktionsvärdena, med vänsterförskjutning för ANA och högerförskjutning för glioblastom.
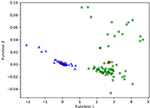
Figur 3. Förhållandet mellan de kanoniska diskriminerande funktionerna från LASSO + LDA-modellerna för glioblastom- och ANA-grupperna (trianglar och cirklar) och för gruppens centroider (kvadrater). Minimal överlappning observerades i denna figur. Kvalitativt sett kunde analysen av de data som valts ut av LASSO skilja glioblastom från ANA. LASSO, least absolute shrinkage and selection operator; LDA, linear discriminant analysis; ANA, Anaplastic astrocytoma.
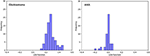
Figur 4. Fördelningen av den direkta LDA-funktionen som bestämts för glioblastom och ANA för en av de 100 oberoende träningscyklerna i dataanalysen för att illustrera prestandan hos LASSO + LDA-modellen. Det fanns tydliga förskjutningar av LDA-funktionsvärdena, med en vänsterförskjutning för ANA och en högerförskjutning för glioblastom. Den minimala överlappningen observeras mellan de två grupperna och en stark kvalitativ likhet är uppenbar mellan diagrammen för cykler och trianglar. LDA, linjär diskriminantanalys; ANA, anaplastiskt astrocytom; LASSO, least absolute shrinkage and selection operator.
Diskussion
Den differentiella diagnosen före behandling mellan glioblastom och ANA är viktig med tanke på den betydande skillnaden i behandlingsstrategi och patientens prognos. MR-undersökning, den viktigaste radiologiska preoperativa undersökningen för hjärntumörer, rekommenderas starkt eftersom den har god känslighet vid upptäckt av lesioner. Den exakta diagnosen före operation är dock fortfarande en utmaning på grund av att båda tumörerna uppvisar liknande egenskaper på konventionella MR-bilder som är bortom mänsklig bedömning med blotta ögat (4, 5). I den här studien extraherade vi texturegenskaper som gör en kvantitativ beskrivning av bilderna för att maximera utnyttjandet av MR-undersökningen, med vilka tre LDA-baserade modeller etablerades. Resultaten visade att MRI-baserad texturanalys i kombination med LDA-algoritmen kunde möjliggöra en genomförbar differentiering mellan glioblastom och ANA.
TA är ett matematiskt tillvägagångssätt för att karakterisera heterogeniteten hos voxelvärdet på bilder. Den skulle kunna visualisera rumslig histologisk heterogenitet som är osynlig för bedömning med det mänskliga ögat (21). Teoretiskt sett skulle egenskaperna hos bilder av lesioner kunna analyseras kvantitativt som texturegenskaper på grund av deras olika förstärkta mönster på MR-bilder (22). Dessutom tyder tidigare studier på att texturegenskaperna kan återspegla en rad onormala patologiska processer i tumören som ödem, effusion och nekros, vilket ger en potentiell mekanism för texturegenskaper för att särskilja glioblastom från ANA (23, 24).
Artificiell intelligens har utforskats i stor utsträckning inom den senaste forskningen. I kombination med texturegenskaper som extraherats från bilder har det rapporterats att den kan hjälpa till med tumörklassificering, klinisk diagnos och resultatförutsägelse. En studie som syftade till att utvärdera den diagnostiska prestandan hos TA-baserade maskininlärningsalgoritmer för att skilja PCNSL från glioblastom presenterade optimal prestanda med en genomsnittlig AUC på 0,921, medan AUC hos tre läsare alla var <0,8. Forskarna drog därför slutsatsen att den diagnostiska prestandan hos TA-baserade maskininlärningsalgoritmer var överlägsen den hos mänskliga läsare (25). Andra studier med liknande syfte visade också liknande resultat med AUC högre än 0,85 (18, 26). Dessutom rapporterade forskare som syftade till att tillämpa maskininlärning vid klassificering av astrocytom också en lovande förmåga till diskriminering (27). I vår studie upprättades klassificeringsmodellerna baserat på LDA-algoritmer. LDA är en statistisk klassificerare som kombinerar inmatade parametrar i en diskriminantfunktion för att klassificera fall i olika grupper (28). Våra resultat visade att den LDA-baserade modellen representerade lovande prestanda för korrekt diagnos mellan glioblastom och ANA.
Antagandet av optimala funktioner för maskininlärningsalgoritmer var en utmaning men var nödvändigt i förhållande till den diagnostiska prestandan. Tidigare studier utför funktionsval med olika metoder: Det finns flera olika metoder för urval av funktioner: Mann-Whitney U-test med ROC:s AUC, Student’s t-test med rekursiv eliminering av funktioner, random forest och entropibaserad diskretisering (18, 25, 29, 30). På grundval av resultaten av dessa studier kan vi dra slutsatsen att den lämpliga urvalsmetoden spelar en nyckelroll för klassificerarens prestanda. När det gäller vår studie extraherades ett relativt stort antal parametrar från olika matriser, vilket ökar chansen att välja de optimala egenskaperna men också ökar svårigheten i valet. Därför utvärderades tre metoder för urval av funktioner (distanskorrelation, LASSO och GBDT) för att välja den med bäst prestanda. Resultaten av denna studie visade att LASSO+LDA var den lämpliga diskriminerande modellen för glioblastom från ANA med högsta AUC i testgruppen på 0,997. LASSO föreslogs som en icke-linjär metod för val av variabler för neurala nätverk i en tidigare studie med fördelen att minimera den gemensamma summan av kvadrerade fel. Den skulle kunna producera tolkningsbara modeller (liknande undergruppsvalet) när den samtidigt uppvisar stabiliteten hos ridge-regression. Tidigare studier visade att den var överlägsen jämfört med andra moderna metoder för val av variabler (31). Vi måste dock tolka resultaten försiktigt, eftersom den ytterligare informationsvinsten från att jämföra olika tekniker för maskininlärning är ganska begränsad, särskilt med tanke på att alla undersökta metoder för klassificering/urval av variabler verkar prestera ganska jämförbart och att variationen i AUC kanske delvis kan tillskrivas den statistiska gruppen. Därför kan vår studie endast betraktas som en hypotesgenerering för framtida, större studier.
Det fanns vissa begränsningar i vår studie. För det första var bias i patienturvalet oundvikligt som en retrospektiv studie på ett enda center. För det andra var antalet inkluderade patienter relativt litet, och ett större antal patienter krävdes i ytterligare studier för att validera resultaten. För det tredje delas ANA nu in i tre kategorier enligt Världshälsoorganisationens klassificering av tumörer i centrala nervsystemet från 2016: IDH-mutant, IDH-vildtyp och NOS (32). Förmågan hos maskininlärning att särskilja subtyper av ANA krävdes för att utforskas i framtida studier. För det fjärde var modellerna för maskininlärning i vår studie faktiskt inte validerade i andra dataset. Vi antog inte andra institutioners dataset eftersom att texturegenskaper kan vara olika när de extraheras från bilder som förvärvats med olika skannrar eller protokoll. Detta kan betraktas som ett tveeggat svärd. Å ena sidan kunde en uppsättning kontrollerade variabler tillhandahållas, å andra sidan kunde resultaten inte garanterat tillämpas i stor skala. Analysprotokollet och bildbehandlingsproceduren var paket med öppen källkod och studier med en stor population krävs för att validera och reproducera våra resultat.
Slutsats
I detta arbete extraherade vi kvantitativa parametrar från kontrastförstärkta MR-bilder och använde tre metoder för funktionsurval för att välja ut de mest diskriminerande parametrarna. Därefter tillämpade vi LDA-algoritmen för att analysera de valda parametrarna. Vår studie visar att texturfunktioner har lovande förmåga att diskriminera glioblastom från ANA. Flercenterstudier med ett större antal patienter är motiverade för att bekräfta detta preliminära resultat.
Datatillgänglighet
Vi delar gärna med oss av våra data till alla kvalificerade forskare utan onödiga förbehåll. Vänligen kontakta motsvarande författare om det finns något de behöver.
Etiskt uttalande
Studierna med mänskliga deltagare granskades och godkändes av den etiska kommittén vid Sichuan University. Skriftligt informerat samtycke till att delta i denna studie gavs av deltagarnas vårdnadshavare/närstående. Skriftligt informerat samtycke inhämtades från individen/individerna och minderårigas vårdnadshavare/närstående för publicering av potentiellt identifierbara bilder eller data som ingår i denna artikel.
Författarnas bidrag
ZT, CC, JX och XM bidrog med utformning och design av studien. CC och XO rekryterade berättigade patienter och erhöll medicinska journaler och MRT-bilder av varje patient. YF och ZT gjorde texturanalyser. JW fastställde modellerna och utförde andra statistiska analyser. ZT skrev det första utkastet till manuskriptet. CC skrev delar av manuskriptet. Samtliga författare bidrog till revidering av manuskriptet, läste och godkände den inlämnade versionen.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller finansiella relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Supplementärt material
Supplementärt material för denna artikel finns online på: https://www.frontiersin.org/articles/10.3389/fonc.2019.00876/full#supplementary-material
Abkortningar
ANA, Anaplastiskt astrocytom; LDA, linjär diskriminantanalys; MRI, Magnetic Resonance Imaging; MR, Magnetic Resonance; LASSO, Least absolute shrinkage and selection operator; GBDT, Gradient correlation decision tree; CSF, Cerebrospinalvätska; TA, Texture analysis; ROI, Regions of interest; HISTO: Histogrambaserad matris; GLCM: Grånivåmatris för samvariation; GLRLM: Grånivåmatris för löplängd; GLZLM: Grånivåmatris för zonlängd; NGLDM: Grannskapsmatris för grånivåberoende; AUC: Area under den karakteristiska mottagarkurvan; PCNSL: Primärt lymfom i det centrala nervsystemet; MLP: Flerlagersperceptron; IDH: Isocitratdehydrogenas.
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancerstatistik, 2012. CA Cancer J Clin. (2015) 65:87-108. doi: 10.3322/caac.21262
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Cancerstatistik i Kina 2015. CA Cancer J Clin. (2016) 66:115-32. doi: 10.3322/caac.21338
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wen PY, Kesari S. Maligna gliom hos vuxna. N Engl J Med. (2008) 359:492-507. doi: 10.1056/NEJMra0708126
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Grimm SA, Chamberlain CM. Anaplastiskt astrocytom. CNS Oncol. (2016) 5:145-57. doi: 10.2217/cns-2016-0002
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Batash R, Asna N, Schaffer P, Francis N, Schaffer M. Glioblastoma multiforme, diagnosis and treatment; recent literature review. Curr Med Chem. (2017) 24:3002-9. doi: 10.2174/0929867324666170516123206
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Weller M, van den Bent M, Hopkins K, Tonn JC, Stupp R, Falini AE, et al. EANO-riktlinje för diagnos och behandling av anaplastiska gliom och glioblastom. Lancet Oncol. (2014) 15:e395-403. doi: 10.1016/s1470-2045(14)70011-7
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Souhami L, Seiferheld W, Brachman D, Podgorsak EB, Werner-Wasik M, Lustig R, et al. Randomiserad jämförelse mellan stereotaktisk radiokirurgi följt av konventionell strålbehandling med karmustin och konventionell strålbehandling med karmustin för patienter med glioblastoma multiforme: rapport från Radiation Therapy Oncology Group 93-05-protokollet. Int J Radiat Oncol Biol Phys. (2004) 60:853-60. doi: 10.1016/j.ijrobp.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Burger PC, Heinz ER, Shibata T, Kleihues P. Topografisk anatomi och datortomografiska korrelationer hos obehandlade glioblastoma multiforme. J Neurosurg. (1988) 68:698-704. doi: 10.3171/jns.1988.68.5.0698
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: the NOA-08 randomised, phase 3 trial. Lancet Oncol. (2012) 13:707-15. doi: 10.1016/s1470-2045(12)70164-x
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chen W, Silverman HD. Framsteg i utvärderingen av primära hjärntumörer. Semin Nucl Med. (2008) 38:240-50. doi: 10.1053/j.semnuclmed.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Burger PC, Vogel FS, Green SB, Strike AT. Glioblastoma multiforme och anaplastiskt astrocytom. Patologiska kriterier och prognostiska konsekvenser. Cancer. (1985) 56:1106-11.
PubMed Abstract | Google Scholar
12. Omuro A, DeAngelis ML. Glioblastom och andra maligna gliom: en klinisk översikt. JAMA. (2013) 310:1842-50. doi: 10.1001/jama.2013.280319
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Lakhman Y, Veeraraghavan H, Chaim J, Feier D, Goldman DA, Moskowitz CS, et al. Differentiering av uterint leiomyosarkom från atypiskt leiomyom: diagnostisk noggrannhet av kvalitativa MR-bildningsegenskaper och genomförbarhet av texturanalys. Eur Radiol. (2017) 27:2903-15. doi: 10.1007/s00330-016-4623-9
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Skogen K, Schulz A, Dormagen JB, Ganeshan B, Helseth E, Server A. Diagnostic performance of texture analysis on MRI in grading cerebral gliomas. Eur J Radiol. (2016) 85:824-9. doi: 10.1016/j.ejrad.2016.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gibbs P, Turnbull WL. Texturanalys av kontrastförstärkta MR-bilder av bröstet. Magn Reson Med. (2003) 50:92-8. doi: 10.1002/mrm.10496
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Castellano G, Bonilha L, Li LM, Cendes F. Texturanalys av medicinska bilder. Clin Radiol. (2004) 59:1061-9. doi: 10.1016/j.crad.2004.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Davnall F, Yip CS, Ljungqvist G, Selmi M, Ng F, Sanghera B, et al. Assessment of tumor heterogeneity: an emerging imaging tool for clinical practice? Insights Imaging. (2012) 3:573-89. doi: 10.1007/s13244-012-0196-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Xiao DD, Yan PF, Wang YX, Osman MS, Zhao YH. Glioblastom och primärt lymfom i centrala nervsystemet: preoperativ differentiering med hjälp av MRI-baserad 3D-texturanalys. Clin Neurol Neurosurg. (2018) 173:84-90. doi: 10.1016/j.clineuro.2018.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Itakura H, Achrol AS, Mitchell LA, Loya JJ, Liu T, Westbroek EM, et al. Magnetic resonance image features identify glioblastoma phenotypic subtypes with distinct molecular pathway activities. Sci Transl Med. (2015) 7:303ra138. doi: 10.1126/scitranslmed.aaa7582
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nioche C, Orlhac F, Boughdad S, Reuze S, Goya-Outi J, Robert C, et al. LIFEx: ett gratisprogram för beräkning av radiomiska egenskaper i multimodal avbildning för att påskynda framstegen i karakteriseringen av tumörheterogenitet. Cancer Res. (2018) 78:4786-9. doi: 10.1158/0008-5472.Can-18-0125
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hu LS, Ning S, Eschbacher JM, Gaw N, Dueck AC, Smith KA, et al. Multiparametrisk MRT och texturanalys för att visualisera rumslig histologisk heterogenitet och tumörutbredning i glioblastom. PLoS ONE. (2015) 10:e0141506. doi: 10.1371/journal.pone.0141506
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Florez E, Nichols T, Parker EE, Lirertte ST, Howard CM, Fatemi A. Multiparametric magnetic resonance imaging in the assessment of primary brain tumors through radiomic features: a metric for guided radiation treatment planning. Cureus. (2018) 10:e3426. doi: 10.7759/cureus.3426
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Mahmoud-Ghoneim D, Alkaabi MK, de Certaines JD, Goettsche MF. Inverkan av bildens dynamiska intervall på texturklassificering av hjärnans vita substans. BMC Med Imaging. (2008) 8:18. doi: 10.1186/1471-2342-8-18
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ahn SY, Park CM, Park SJ, Kim HJ, Song C, Lee SM, et al. Prognostiskt värde av datortomografiska texturdetaljer i icke-småcellig lungcancer som behandlas med definitiv samtidig kemoradioterapi. Invest Radiol. (2015) 50:719-25. doi: 10.1097/rli.0000000000000174
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Suh HB, Choi YS, Bae S, Ahn SS, Chang JH, Kang SG, et al. Primärt lymfom i centrala nervsystemet och atypiskt glioblastom: Differentiering med hjälp av radiomik. Eur Radiol. (2018) 28:3832-9. doi: 10.1007/s00330-018-5368-4
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mouthuy N, Cosnard G, Abarca-Quinones J, Michoux N. Multiparametric magnetic resonance imaging to differate high-grade gliomas and brain metastases. J Neuroradiol. (2012) 39:301-7. doi: 10.1016/j.neurad.2011.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Glotsos D, Spyridonos P, Cavouras D, Ravazoula P, Dadioti PA, Nikiforidis G. An image-analysis system based on support vector machines for automatic grade diagnosis of brain-tumour astrocytomas in clinical routine. Med Inform Internet Med. (2005) 30:179-93. doi: 10.1080/14639230500077444
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dellacasa Bellingegni A, Gruppioni E, Colazzo G, Davalli A, Sacchetti R, Guglielmelli E, et al. NLR, MLP, SVM, and LDA: a comparative analysis on EMG data from people with trans-radial amputation. J Neuroeng Rehabil. (2017) 14:82. doi: 10.1186/s12984-017-0290-6
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Ion-Margineanu A, Van Cauter S, Sima DM, Maes F, Sunaert S, Himmelreich U, et al. Classifying glioblastoma multiforme follow-up progressive vs. responsive forms using multi-parametric MRI features. Front Neurosci. (2016) 10:615. doi: 10.3389/fnins.2016.00615
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Fetit AE, Novak J, Peet AC, Arvanitits NT. Tredimensionella texturella egenskaper hos konventionell MRT förbättrar den diagnostiska klassificeringen av hjärntumörer hos barn. NMR Biomed. (2015) 28:1174-84. doi: 10.1002/nbm.3353
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Sun K, Huang SH, Wong DS, Jang SS. Utformning och tillämpning av en metod för val av variabler för neurala nätverk med flerskiktsperceptron med LASSO. IEEE Trans Neural Netw Learn Syst. (2017) 28:1386-96. doi: 10.1109/tnnls.2016.2542866
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. Världshälsoorganisationens klassificering 2016 av tumörer i centrala nervsystemet: en sammanfattning. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar




