Frontiers in Pharmacology
Introduktion
Olanzapin är en av de mest använda andra generationens antipsykotika för schizofreni, bipolär sjukdom och psykotiska symptom. Förutom att förbättra de viktigaste symtomen på psykos visar olanzapin stor acceptans, minskar avbrott av alla orsaker och förebygger framtida återfall (Leucht et al., 2009). Många randomiserade kliniska studier (RCT) och metaanalyser har föreslagit att olanzapin är ett av de mest effektiva antipsykotiska läkemedlen för patienter med schizofreni (Leucht et al., 2013; Huhn et al., 2019).
Den vanligaste biverkningen av olanzapin är viktuppgång (Allison et al., 1999). Olanzapin framkallar mest viktökning av de SGA. CAFE-studien (Comparison of Atypicals for First Episode) visade att 80 % av de patienter som behandlades med olanzapin ökade mer än 7 % av sin ursprungliga kroppsvikt vid vecka 52 (McEvoy et al., 2007). Avbrottsfrekvensen för olanzapin på grund av viktökning eller åtföljande metaboliska effekter var 2-8 gånger högre än för andra antipsykotika i studien Clinical Antipsychotic Trials in Intervention Effectiveness (CATIE) (Lieberman et al., 2005). Förutom att vara förknippad med minskad följsamhet till läkemedelsbehandlingen är viktökning också förknippad med betydande medicinsk morbiditet och mortalitet. Med tanke på den höga fetmanivån hos patienter med schizofreni (42 %) bör den potentiella risken för olanzapininducerad viktökning utvärderas noggrant (Newcomer, 2006). Vissa randomiserade kontrollerade studier (RCT) har visat att patienter med psykiska sjukdomar dör upp till 30 år tidigare än den allmänna befolkningen (Das-Munshi et al., 2017). Den främsta dödsorsaken i denna population är hjärtsjukdomar. En viktig riskfaktor för hjärtsjukdom och för tidig död hos dessa patienter är viktökning (Fekadu et al., 2015).
Mekanismerna bakom antipsykotikainducerad viktökning och negativa metabola effekter är inte väl förstådda (Correll et al., 2011). Olanzapin förknippas med förhöjd aptit och ökat födointag och minskad aktivitet eller försämrad metabolisk reglering (Roerig et al., 2005; Henderson et al., 2015). Fountaine et al. rapporterade att hos friska män ökade olanzapin kroppsvikten genom ökat matintag, utan tecken på minskade aktivitets- eller utgiftsnivåer (Fountaine et al., 2010). Denna observation stämmer överens med observationer av manliga tonåriga slutenvårdspatienter med schizofreni (Gothelf et al., 2002). Patienterna hade signifikant ökat kroppsmasseindex på grund av ökat kaloriintag efter fyra veckors olanzapinbehandling (Gothelf et al., 2002). De nuvarande bevisen för sambandet mellan aptit och viktökning är dock inte entydiga (Poyurovsky et al., 2007; Case et al., 2010). Case et al. rapporterade att tidiga aptitförändringar inte var konsekvent korrelerade med den totala viktförändringen i fyra olika prövningar (Case et al., 2010). Vidare har ingen studie rapporterat den exakta tidpunkten för aptitökningen, jämfört viktökningshastigheten i förhållande till tidpunkten för ökad aptit eller bedömt skillnader i viktökning och metaboliska effekter mellan patienter med ökad eller oförändrad aptit. Därför utvärderade vi sambandet mellan aptitökning och olanzapininducerade viktförändringar och åtföljande metaboliska effekter hos läkemedelsnaiva patienter med schizofreni i första episoden.
Material och metoder
Deltagare
Denna studie genomfördes vid institutet för psykisk hälsa vid andra Xiangya-sjukhuset, Centrala syduniversitetet, Kina mellan december 2016 och april 2019. Deltagarna bedömdes för schizofreni i enlighet med de kriterier som definieras i Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition (DSM-5) (A.P. Association, 2013). Eftersom antipsykotika-naiva/första episoden-patienter verkar gå upp mer i vikt efter olanzapinbehandling (Correll et al, 2011), inkluderade vi första episoden schizofrenipatienter i åldern 18-50 år ingick i denna studie.
Exklusionskriterierna omfattade (i) kliniskt onormala fynd vid fysiska undersökningar, laboratorietester eller resultat från elektrokardiogram (EKG), (ii) störningar såsom intellektuell funktionsnedsättning, substans- eller alkoholmissbruk, en diagnos av andra specifika systemsjukdomar enligt DSM-5-kriterierna; (iii) kardiovaskulära och metabola sjukdomar som diabetes mellitus, dyslipidemi och högt blodtryck; (iv) en historia av ätstörningar; (v) strikt diet inom månaden före screening eller under studien; och (vi) graviditet eller amning.
Intervention
Förra studier har antytt att den olanzapininducerade viktökningen var snabbast under de första 12 veckorna av behandlingen (Correll et al, 2009). Därför behandlades deltagarna med olanzapin (15-20 mg/dag kl. 20.00 på kvällen) i 12 veckor. Den initiala dosen olanzapin var 5 mg/dag och justerades sedan till 15-20 mg/dag under den första veckan.
Bedömning
Baslinjebedömningarna omfattade demografiska uppgifter, en grundlig anamnes, antropometriska mätningar (vikt och längd), aptit, fysisk undersökning och laboratorieanalyser. Aptiten bedömdes dagligen, 30 min före lunch, med fyra standardiserade frågor: Hungrig, Känner mig mätt, Tänker på mat och Överätning. Svaren graderades på en skala från 0 till 10, där 0 = ”inte alls” och 10 = ”extremt”. Aptitökning definierades som en >10 % ökning av baslinjevärdena för aptit. Aptitminskning definierades som en >10 % minskning av aptitvärdena i utgångsläget. Positive and Negative Syndrome Scale (PANSS) användes för att utvärdera svårighetsgraden av schizofrenisymtomen. Biverkningar utvärderades med hjälp av Treatment Emergent Symptom Scale (TESS). Vid varje uppföljningsbesök upprepades alla baslinjeutvärderingar (inklusive fysisk undersökning, antropometriska mätningar, aptit och TESS) utom PANSS. PANSS utvärderades på nytt vid vecka 12.
För behandling och i fastande tillstånd mättes vikt och längd efter att deltagarna tagit av sig skor med lätta inomhuskläder. Aptiten bedömdes före lunch och baserades på bedömningen av bedömningsläkaren på undersökningsdagen. Laboratoriearbete inklusive plasmaglukos, lever- och njurfunktion utvärderades med hjälp av enzymatiska förfaranden med den automatiserade kemiska analysatorn Boehringer Mannheim/Hitachi 714. Insulin mättes med en ELISA (enzyme-linked immunosorbent assays) i fast fas.
De primära resultaten var andelen patienter som hade ökad aptit och tidsperioden mellan olanzapinbehandling och ökad aptit. Sekundära utfall omfattade förändringar i vikt, kroppsmasseindex (BMI), fasteglukos, fastande insulin och insulinresistensindex, lipidprofiler som omfattade triglycerider, kolesterol, lipoprotein med hög densitet (HDL-C) och lipoprotein med låg densitet (LDL-C) samt PANSS-poäng. BMI beräknades enligt kriterierna från arbetsgruppen för fetma i Kina: hälsosam vikt (18,5 ≤ BMI <25 kg/m2), övervikt (25 ≤ BMI ≤ 28 kg/m2) och fetma (BMI > 28 kg/m2). Dyslipidemi definierades som kolesterol ≥ 5,18 mmolċl-1, triglycerider ≥ 1,70 mmolccl-1, HDL-C < 1,04 mmolccl-1 eller LDL-C ≥ 3,37 mmolccl-1 enligt de kinesiska riktlinjerna för dyslipidemi (Hu, 2017). En analys av andelen patienter som ökade mer än 7 % av sin grundvikt efter 12 veckor, vilket är gränsvärdet för kliniskt signifikant viktökning, ingick också (Kanders et al., 1991).
Statistisk analys
Statistical Package for Social Sciences, version 25.0 (SPSS v25.0) användes för statistisk analys. Kontinuerliga variabler och kategoriska variabler beskrivs med hjälp av sammanfattande statistik (medelvärden och standardavvikelser) respektive frekvenser och procentandelar. Students t-test och chi square-analyser användes för att analysera skillnader mellan grupperna i förändringar av kroppsvikt, BMI, fasteglukos och insulin, insulinresistensindex, triglycerider, kolesterol, HDL-C och LDL-C från baslinjen till varje tidpunkt. Vi undersökte sambandet mellan vikt, BMI, insulinresistensindex, LDL-C och aptit med hjälp av linjär regressionsanalys. Ett P-värde (p) < 0,05 ansågs vara statistiskt signifikant.
Resultat
Totalt 33 inpatienter med schizofreni (medelålder, 23,5 år; intervall 18-36 år) deltog i studien. Det fanns en högre andel kvinnliga patienter (63,6 %, 21/33). Alla patienter låg inom det normala BMI-området (genomsnittligt BMI, 21,3 ± 1,7 kg/m2). Den genomsnittliga varaktigheten av schizofreni var 11,2 ± 3,7 (intervall 5-18) månader. Två kvinnliga patienter hoppade av studien efter 4 veckor på grund av ökad aptit; de återstående 31 (93,9 %) deltagarna fullföljde studien (tabell 1).
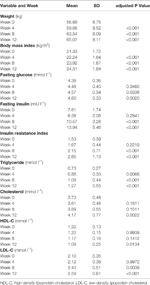
Tabell 1 Sammanfattning av vikt- och metaboliska mått per studie.
Appetitsökning efter olanzapinbehandling
Efter 12 veckors olanzapinbehandling hade 77,4 % (24/31) patienter ökad aptit och 22,6 % (7/31) patienter hade oförändrad aptit. Som framgår av figur 1, för de 24 patienter som hade ökad aptit, började aptitökningen inom de första 8 veckorna av olanzapinbehandlingen och varade fram till slutet av behandlingen. Medeltiden från olanzapinbehandlingsstart till aptitökning var 20,3 dagar (SD = 14,4), och 25,0 % (6/24) och 70,8 % (17/24) ökade sin aptit inom 1 vecka respektive 4 veckor. Två patienter ökade sin aptit den tredje dagen efter olanzapinbehandlingen. Ingen signifikant skillnad hittades i olanzapininducerad aptit mellan olika kön med hjälp av tvåvägsanalys ANOVA.
Figur 1 Antal patienter med ökad aptit under 8 veckors olanzapinbehandlingsperioder.
Förändringar av kroppsvikt och BMI efter olanzapinbehandling
Signifikanta ökningar av vikt och BMI observerades efter olanzapinbehandling (tabell 1). Den genomsnittliga viktökningen var 7,9 kg under den 12 veckors olanzapinbehandlingen, med patienter som ökade 2,4, 4,0 och 1,5 kg vid den första, andra respektive tredje 4-veckorsperioden. Kvinnliga patienter var mer benägna att gå upp i vikt (P < 0,001), med 9,19 kg genomsnittlig viktökning under studieperioden jämfört med 5,90 kg viktökning hos manliga patienter. Av de totala patienterna ökade 80,6 % (25/31) och 61,3 % (19/31) sin ursprungliga kroppsvikt med mer än 7 % respektive 10 % under den 12 veckor långa olanzapinbehandlingen (kompletterande tabell 1). Efter 12 veckor blev 51,6 % (16/31) av patienterna överviktiga (BMI>25 kg/m2).
Förändringar av metabola störningar efter olanzapinbehandling
Signifikanta ökningar av fasteglukos, fasteinsulin, insulinresistensindex, triglycerider, kolesterol och LDL-C och minskningar av HDL-C observerades efter 12 veckor (tabell 1). Ingen patient som ingick i studien hade dyslipidemi vid baslinjen. Baserat på kinesiska riktlinjer för dyslipidemi hade 38,7 % (12/31) av patienterna dyslipidemi efter 12 veckors olanzapinbehandling.
Appetitökning och olanzapininducerad viktökning
För att upptäcka effekten av ökad aptit på olanzapininducerad viktökning delade vi in patienterna i två grupper (grupp med ökad aptit och grupp med oförändrad aptit ) baserat på om aptiten ökade eller inte efter 12 veckors olanzapinbehandling.
Jämfört med gruppen med oförändrad aptit fanns det signifikanta ökningar av vikt och BMI-nivåer i gruppen med ökad aptit efter 12 veckors olanzapinbehandling (tabell 2). Figur 2 visade jämförelsen av viktökning och metaboliskt relaterade utfall mellan grupperna med ökad och oförändrad aptit. Detaljerade analyser presenterades i kompletterande tabell 2. Viktökningen mellan två grupper var signifikant (P = 0,01) med hjälp av tvåvägsanalys ANOVA. Medelvikten ökade med 9,1 kg (SD = 4,1) i gruppen med ökad aptit och 3,9 kg (SD = 2,0) i gruppen med oförändrad aptit med signifikant skillnad mellan de två grupperna under 12 veckors behandlingsperiod med olanzapin. En större andel av patienterna (91,7 %) i gruppen med ökad aptit ökade mer än 7 % av sin ursprungliga kroppsvikt efter 12 veckor jämfört med patienterna i gruppen med oförändrad aptit (42,9 %; χ2 = 8,27, df = 1, p = 0,004). På samma sätt ökade fler patienter i gruppen med ökad aptit (19/24, 79,2 %) mer än 10 % av den ursprungliga kroppsvikten efter 12 veckor jämfört med patienter i gruppen med oförändrad aptit (0,0 %; χ2 = 14,32, df = 1, p < 0,001) (kompletterande tabeller 3-5). Efter 12 veckors olanzapinbehandling blev 58,3 % av patienterna överviktiga i gruppen med ökad aptit jämfört med 28,6 % av patienterna i gruppen med oförändrad aptit. Appetitökning medierade starkt olanzapininducerad viktökning med medierande effekt 66,2 %.

Tabell 2 Beskrivande statistik över utfallsmått mellan grupperna med ökad och oförändrad aptit vid baslinjen och veckorna 4, 8 och 12.
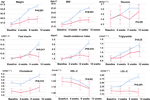
Figur 2 Jämförelse av kroppsvikt, BMI, glukos- och lipidnivåer mellan grupper med ökad och oförändrad aptit. Blå linje anger patienter med ökad aptit; röd linje anger patienter med oförändrad aptit.
Apptitökning och Olanzapininducerade metabola störningar
Det fanns signifikanta skillnader i insulin (p = 0,017), insulinresistensindex (p = 0,015) och LDL-C (p = 0,001) mellan grupperna med ökad aptit och oförändrad aptit efter 12 veckor (figur 2 och tabell 2). Fyra patienter i gruppen med ökad aptit hade kolesterol ≥ 5,18 mmolċl-1, nio hade triglycerider ≥ 1,70 mmolccl-1, sex hade HDL-C < 1,04 mmolccl-1 och tre hade LDL-C ≥ 3,37 mmolccl-1 vid vecka 12. Totalt hade 13/24 patienter i gruppen med ökad aptit dyslipidemi efter 12 veckor, medan ingen av patienterna i gruppen med oförändrad aptit utvecklade dyslipidemi under studieperioden (tabell 3).

Tabell 3 Dyslipidemi definierad av varje enskilt utfallsmått i grupperna med ökad och oförändrad aptit.
Den högsta viktökningen uppnåddes en månad efter månaden för aptitökning
I gruppen med ökad aptit analyserade vi den genomsnittliga viktökningen för varje patient vid fyra tidpunkter: före månaden för tid för aptitökning (-1M), månaden för tid för aptitökning (0M), en månad efter aptitökning (+1M) och två månader efter aptitökning (+2M). Jämfört med -1M ökade viktökningen vid 0M, men denna förändring var inte signifikant (-1M vs. 0M, 1,4 ± 1,2 kg vs. 3,1 ± 1,4 kg). Viktökningen gick in i en topptillväxt vid +1M, med en 4,3 ± 2.En ökning med 4 kg. Viktökningen avtog vid +2M (p < 0,001) med 1,6 ± 1,5 kg. Viktökningen vid +2M avtog och stabiliserades, och inga signifikanta skillnader observerades jämfört med -1M (figur 3 och kompletterande tabell 6).
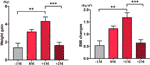
Figur 3 Genomsnittlig viktökningshastighet i gruppen med ökad aptit. Den genomsnittliga viktökningen för varje patient per månad under studieperioden analyserades vid fyra tidpunkter: före månaden för ökad aptit (-1M), månaden för ökad aptit (0M), 1 månad efter månaden för ökad aptitökning (+1M) och 2 månader efter månaden för ökad aptit (+2M). ** indikerar P < 0,01, *** indikerar P < 0,001.
Främre ökad aptit förutsäger mer viktökning i 1 månad efter månaden för aptitökning
Vi jämförde vidare viktökningshastigheten hos deltagare med ökad aptit inom 4 veckor (A) och deltagare med ökad aptit mellan 4 och 8 veckor (B). Vid 0M var viktökningshastigheten mellan deltagare med ökad aptit inom 4 veckor och deltagare med ökad aptit mellan 4 och 8 veckor inte signifikant annorlunda. Deltagare med tidigare ökad aptit visade dock signifikant ökad viktökningshastighet vid +1M. Dessa resultat visade att tidigare ökad aptit kan leda till större viktökning under uppföljningsperioden (figur 4). Liknande förändringar i BMI observerades under de fyra tidpunkterna (figurerna 3 och 4).
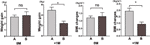
Figur 4 Jämförelse av viktökningshastighet hos deltagare med ökad aptit under olika månader. Vi jämförde viktökningshastigheten hos deltagare med ökad aptit inom 4 veckor (A) och deltagare med ökad aptit mellan 4 och 8 veckor (B) i månaden med tid till ökad aptit (0M) och 1 månad efter månaden med tid till ökad aptit (+1M). ns, indikerar ej signifikant, * indikerar P < 0,05.
Appetiten och hastigheten på förändringar av metaboliska störningar
Detaljerade beskrivande data för förändringar av vikt, BMI, fasteglukos, insulin, insulinresistensindex, triglycerider, kolesterol, HDL-C och LDL-C sammanfattas i tabell 2. För att undersöka sambandet mellan ökad aptit och glukos- och lipidmetabolism analyserade vi förändringar i dessa indikatorer vid fyra tidpunkter i gruppen med ökad aptit. Inga signifikanta hastighetsförändringar observerades för glukos, triglycerid, HDL-C och LDL-C vid någon tidpunkt. Signifikanta hastighetsökningar för insulin och insulinresistensindex observerades endast vid +2M (kompletterande figur 1 och kompletterande tabell 6). Ytterligare jämförelser tydde på att deltagare med ökad aptit inom 4 veckor inte uppvisade signifikant ökad hastighet av insulin och insulinresistensindex vid 0M och +1M jämfört med deltagare med ökad aptit mellan 4 och 8 veckor (Kompletterande figur 2).
Att förutsäga aptiten på Olanzapininducerad viktuppgång och metaboliska störningar
Vi utförde en linjär regressionsanalys för att utvärdera effekten av aptithöjning på viktuppgång, blodglukos- och lipidnivåer. Efter kontroll av statistiskt signifikanta variabler som kön, ålder, längd och duration inkluderade vi viktökning, BMI, fasteglukos, insulin, insulinresistensindex, triglycerider, kolesterol, HDL-C och LDL-C som beroende variabler och aptit som oberoende variabel i regressionsanalysen. Aptitökning var förknippad med förändringar i vikt (β = 0,67, p = 0,0003), BMI (β = 0,63, p = 0,0004), insulin (β = 0,49, p = 0,019), insulinresistensindex (β = 0,51, p = 0,0149) och LDL-C (β = 0.61, p = 0,0035) (Kompletterande tabell 7).
Signifikanta förbättringar från baslinje till slutpunkt av kliniska symtom (utvärderade med PANSS, p < 0,001) observerades efter olanzapinbehandling. Ingen signifikant skillnad i PANSS observerades mellan grupperna med ökad aptit och oförändrad aptit (p > 0,05).
Biverkningar
Av alla 31 patienter som avslutade studien var nio (29.0 %) patienter rapporterade hypoaktivitet, åtta (25,8 %) patienter rapporterade somnolens, fyra (12,9 %) patienter hade onormala leverprover, två (6,5 %) patienter rapporterade akathisia, fyra (12,9 %) patienter hade förstoppning, en (3.2 %) patient hade diarré och två (6,5 %) patienter kände sig yr och 80,6 % (25/31) patienter ökade sin kroppsvikt med mer än 7 % under studieperioden.
Diskussion
I denna prospektiva studie visade de viktigaste resultaten att 77,4 % av patienterna ökade sin aptit efter olanzapinbehandlingen, och dessa patienter som ökade sin aptit gick upp mer i vikt än de patienter som hade oförändrad aptit (9,1 kg mot 3,9 kg). På samma sätt ökade fler patienter i gruppen med ökad aptit sin ursprungliga kroppsvikt med mer än 7 eller 10 %, vilket tyder på att ökad aptit är förknippad med betydande viktökning hos läkemedelsnaiva patienter med schizofreni i första episoden som behandlas med olanzapin. Dessutom stödde linjär regressionsanalys också att aptitökningen var starkt relaterad till olanzapininducerad viktökning. Dessa resultat överensstämde med tidigare rapporter (Gothelf et al., 2002; Cope et al., 2005). Murashita et al. (2005) observerade ökade aptitstimulerande ghrelinnivåer och kroppsfettprocent hos schizofrenipatienter som behandlades med olanzapin. Resultaten från en randomiserad dubbelblind studie tydde på att olanzapin framkallade matbegär och binge eating i större utsträckning än klozapin (Murashita et al., 2005; Kluge et al., 2007). Liknande resultat rapporterades också hos möss som behandlades med olanzapin (Cope et al., 2005). Olanzapins verkan på flera receptorplatser, särskilt D2- och 5H3-receptorerna, som modulerar aptiten, har också tillämpats vid behandling av anorexia nervosa och kemoterapiinducerat illamående och kräkningar (Kluge et al., 2007; Tan et al., 2009; Kafantaris et al., 2011).
Vi fann också att 70,8 % av patienterna ökade sin aptit inom de första fyra veckorna av den inledande olanzapinbehandlingen med ett medelvärde på 20,3 dagar för ökningen. Vissa patienter ökade till och med sin aptit redan den tredje dagen efter olanzapinbehandlingen. Intressant är att patienter vars aptit ökade tidigare i tiden sannolikt gick upp mer i vikt än patienter vars aptit ökade senare i tiden, och viktökningen kulminerade 1 månad efter att den ökade aptiten inträffade. Även om ingen signifikant skillnad hittades i olanzapininducerad aptit mellan manliga och kvinnliga patienter, var kvinnliga patienter mer benägna att gå upp i vikt (P < 0,001). Därför bör aptiten betraktas som en indikator för att förutsäga olanzapininducerad viktökning, särskilt hos kvinnliga patienter. I kliniska miljöer bör läkare vara mer uppmärksamma på patienter vars aptit ökar tidigt efter olanzapinbehandling och bör starta en plan för att förebygga viktuppgång.
Olanzapinbehandlade patienter uppvisade en ökning på mer än 7 % av den ursprungliga kroppsvikten, vilket stämmer överens med tidigare fynd (Gothelf et al., 2002; Wu et al., 2008). Förutom en betydande viktökning hade patienter med olanzapinbehandling signifikant störd glukos- och lipidmetabolism efter 12 veckor, vilket överensstämmer med tidigare publicerade observationer hos patienter med schizofreni (Correll et al., 2011). Jämfört med patienter i gruppen med oförändrad aptit hade gruppen med ökad aptit betydande lipidavvikelser. Fasteglukos var inte signifikant annorlunda mellan de två grupperna. Deltagare med tidig ökad aptit uppvisade inte ökad hastighet av insulin och insulinresistensindex under de följande månaderna efter ökad aptit. Det är möjligt att glukosnivåerna är oberoende av viktökning, eftersom aptiten inte påverkade glukosnivåerna.
Observerade negativa fysiska hälsoeffekter i samband med antipsykotika, såsom viktökning, metabola störningar och relaterad sjuklighet, har länge uppmärksammats (Wu et al., 2016). Tidigare studier har föreslagit att aptit kan förutsäga olanzapininducerad viktökning och negativa metaboliska effekter (Gothelf et al., 2002; Poyurovsky et al., 2007; Fountaine et al., 2010). Såvitt vi vet är detta den första studien som bedömer sambandet mellan aptit, viktökning och metaboliska störningar efter olanzapinbehandling hos läkemedelsnaiva schizofrenipatienter i första episoden. Vissa resultat ger oss mer bevis för hur man väljer medicinering på ett rimligt sätt i kliniskt arbete och ger fler fördelar för att förebygga olanzapininducerad viktökning och metabola störningar.
Det finns flera begränsningar i vår studie. För det första mätte den här studien inte matintag såsom måltider och mellanmål, även om alla inkluderade patienter fick samma standardiserade matmeny. Ett högt fett- och fruktosintag kan minska aptitkontrollen genom att påverka den centrala aptitregleringen. Faktum är att dieter med hög fruktos har negativa effekter på central aptitsignalering och kognitiv funktion (Lowette et al., 2015; Dalvi et al., 2017). För det andra undersökte vi inte leptin- och ghrelinnivåerna under studieperioden. Leptin och ghrelin, som utsöndras från fettvävnad respektive mage, spelar avgörande roller i regleringen av födointag och energiomsättning (Cui et al., 2017). Flera studier fann ökade leptinnivåer och minskade ghrelinnivåer under de första veckorna efter inledd olanzapinbehandling (Basoglu et al., 2010; Stip et al., 2012; Lu et al., 2015). Ökningen av leptinnivån förblir stabil i flera veckor, men ghrelinnivån ökar under den längre perioden (Sentissi et al., 2008). Ytterligare forskning bör övervaka leptin- och ghrelinreaktionerna på aptitökning samt deras samband med metaboliska parametrar och kliniska effekter. Dessutom övervakade vi inte aktivitetsnivåerna under studieperioden. Även om vissa studier rapporterade att olanzapin ökade kroppsvikten enbart genom att öka aptiten och matintaget, utan några signifikanta skillnader i vilande energiförbrukning (Gothelf et al., 2002; Fountaine et al., 2010). Ett antal studier rapporterade minskad fysisk aktivitet med olanzapinmedicinering (Perez-Cruzado et al., 2018). I vår studie rapporterade 29,0 % av patienterna hypoaktivitet och 25,8 % av patienterna somnolens under den 12 veckors olanzapinbehandlingsperioden. Hillebrand et al. (2005) fann att olanzapinbehandling minskade den fysiska fysiska aktiviteten hos råttor som utsattes för aktivitetsbaserad anorexi. Olanzapinbehandling minskade också aktivitetsnivåerna hos patienter med anorexia nervosa, utan signifikanta skillnader i kroppsvikt och plasmanivåer av leptin jämfört med obehandlade patienter. Vår tidigare studie visade att livsstilsinterventioner, som inkluderade psykoedukativa, kost- och motionsprogram, kan minska antipsykotikainducerad viktökning (Wu et al., 2008). Dessutom skulle det vara bättre att jämföra fler patienter med friska kontroller i samma ålder, vilket kan hjälpa till att tolka olanzapininducerad aptitökning och metaboliska förändringar är specifikt relaterade till dess farmakologiska egenskaper. Ytterligare studier bör fokusera på mekanismerna för ökad aptit efter olanzapinbehandling (Koopmann et al., 2012; Sweeney et al., 2017; Mancuso et al., 2019). Belöningssystemet i striatala regioner kan vara förknippat med antipsykotika-associerad viktökning (Nielsen et al., 2016). Förändrad aktivitet i den subgenuala främre cingulära cortex kan också delvis ligga bakom ökad aptit efter olanzapinbehandling (Pawlowski et al., 2018). Avbildningsstudier bör utföras för att undersöka olanzapins modulering av relaterad djup hjärnaktivitet relaterad till aptit.
Slutsatser
Slutsatsen är att vår studie har visat att aptit är relaterad till olanzapininducerad viktuppgång och dyslipidemi hos läkemedelsnaiva förstagångsepisodpatienter med schizofreni. Bedömning av aptitförändringar är ett enkelt och praktiskt sätt att förutsäga viktökning, vilket ger kliniker mer tid och fler alternativ för interventionsstrategier. Tidiga kostinventeringar som syftar till att minska aptiten och minska matintaget kan vara till hjälp för viktkontroll hos schizofrenipatienter som behandlas med olanzapin.
Data Availability Statement
Den datamängd som genererades för den här studien är tillgänglig på begäran till motsvarande författare.
Etiskt uttalande
Denna studie utfördes i enlighet med Helsingforsdeklarationen (G.A.o.t.W.M. Association, 2013) och godkändes av den etiska kommittén vid Second Xiangya Hospital, Central South University. Efter en fullständig beskrivning av studien till deltagarna erhölls informerat samtycke före studiedeltagande.
Författarbidrag
JH analyserade och tolkade patientdata och bidrog i hög grad till att skriva manuskriptet. G-RH utformade och utförde huvudsakligen studien. YeY, C-CL, J-MX, Y-JL och X-JP hjälpte till med patientrekrytering, övervakning av datakvaliteten och dokumentation av behandlingsuppkomna biverkningar. YiY hjälpte till att revidera manuskriptet. J-PZ vägledde studiens utformning. RR-W var ansvarig för det övergripande innehållet. Alla författare läste och godkände det slutliga manuskriptet.
Finansiering
Detta arbete stöddes av Key R&D Program Projects, National Science Foundation of China (Grant No.2016YFC1306900) och National Nature Science Foundation of China (Grant No.81622018. och nr 81901401).
Intressekonflikt
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
Vi vill tacka för deltagarnas värdefulla bidrag och stödet från deras allmänläkare. Vi vill också tacka flera anonyma granskare för deras värdefulla kommentarer och förslag för att förbättra kvaliteten på artikeln.
Supplementary Material
Supplementary Material for this article can be found online at: https://www.frontiersin.org/articles/10.3389/fphar.2020.00739/full#supplementary-material
Supplement Figur 1 | Hastigheten av blodglukos- och lipidförändringar i gruppen med ökad aptit. De genomsnittliga förändringsvärdena för varje patient per månad under studieperioden analyserades vid fyra tidpunkter: före månaden med ökad aptit (-1M), månaden med ökad aptit (0M), 1 månad efter månaden med ökad aptitökning (+1M) och 2 månader efter månaden med ökad aptit (+2M).
Supplementfigur 2 | Jämförelse av insulin- och insulinresistensindexets förändringshastighet hos deltagare med ökad aptit under olika månader. Vi jämförde hastigheten hos deltagare med ökad aptit inom 4 veckor (A) och deltagare med ökad aptit mellan 4-8 veckor (B) i månaden för tid till ökad aptit (0M) och 1 månad efter månaden för tid till ökad aptit (+1M).
Tilläggstabell 1 | Antal patienter som hade ökat den ursprungliga kroppsvikten med mer än 7 % eller 10 % vid vecka 4, 8 och 12.
Tilläggstabell 2 | Antal patienter som hade ökat den ursprungliga kroppsvikten med mer än 7 % eller 10 % vid vecka 4, 8 och 12 hos patienter med ökad aptit.
Tilläggstabell 3 | Antal patienter som hade ökat den initiala kroppsvikten med mer än 7 % eller 10 % vid veckorna 4, 8 och 12 hos patienter med oförändrad aptit.
Tilläggstabell 4 | Jämförelse av antal med 7 % eller 10 % viktökning mellan patienter med ökad aptit och patienter med oförändrad aptit vid veckorna 4, 8 och 12.
Tilläggstabell 5 | Analys av hastigheten av genomsnittlig viktökning, glukos- och lipidförändringar i gruppen med ökad aptit vid fyra tidpunkter: före månaden med tid för aptitökning (-1M), månaden med tid för aptitökning (0M), 1 månad efter månaden med tid för aptitökning (+1M) och 2 månader efter månaden med tid för aptitökning (+2M). ns indikerar ej signifikant, * indikerar p-värde < 0,05, ** indikerar p-värde < 0,01, *** indikerar p-värde < 0,001.
Tilläggstabell 6 | Uppskattningar av aptiteffekter på viktuppgång och metaboliskt relaterade utfallsmått från en allmän linjär blandad modell samtidigt som man kontrollerar för ålder, sjukdomstid och kön.
Tilläggstabell 7-1 | Förändringar av vikt, BMI, insulin, IRI och LDL-C per patient under behandlingsperioden i olika grupper.
Tilläggstabell 7-2 | Uppskattningar av aptiteffekter på viktökning och metaboliskt relaterade utfallsmått.
Abkortningar
SGA, andra generationens antipsykotika; RCT, randomiserad klinisk prövning; CAFÉ, The Comparison of Atypicals for First Episode; CATIE, The Clinical Antipsychotic Trials in Intervention Effectiveness; DSM-5, The Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition; EKG, elektrokardiogram; PANSS, The Positive and Negative Syndrome Scale; TESS, Treatment Emergent Symptom Scale; ELISA, Enzyme-linked Immunosorbent Assays; BMI, Body Mass Index; HDL-C, High Density Lipoprotein; LDL-C, Low Density Lipoprotein.
Allison, D. B., Mentore, J. L., Heo, M., Chandler, L. P., Cappelleri, J. C., Infante, M. C., et al. (1999). Antipsykotika-inducerad viktökning: en omfattande forskningssyntes. Am. J. Psychiatry 156, 1686-1696. doi: 10.1176/ajp.156.11.1686
PubMed Abstract | CrossRef Full Text | Google Scholar
Association, A.P. (2013). Diagnostic and statistical manual of mental disorders (DSM-5®) (Arlington, VA: American Psychiatric Pub).
Google Scholar
Basoglu, C., Oner, O., Gunes, C., Semiz, U. B., Ates, A. M., Algul, A., et al. (2010). ghrelin-, cholecystokinin-, visfatin-, leptin- och agouti-relaterade proteinnivåer under sex veckors olanzapinbehandling hos manliga patienter med psykos i första episoden. Int. Clin. Psychopharmacol. 25, 165-171. doi: 10.1097/YIC.0b013e3283377850
PubMed Abstract | CrossRef Full Text | Google Scholar
Case, M., Treuer, T., Karagianis, J., Hoffmann, V. P. (2010). Appetitens potentiella roll för att förutsäga viktförändringar under behandling med olanzapin. BMC Psychiatry 10, 72. doi: 10.1186/1471-244X-10-72
PubMed Abstract | CrossRef Full Text | Google Scholar
Cope, M., Nagy, T., Fernandez, J., Geary, N., Casey, D., Allison, D. (2005). Antipsykotiska läkemedelsinducerad viktökning: utveckling av en djurmodell. Int. J. Obes. 29, 607. doi: 10.1038/sj.ijo.0802928
CrossRef Full Text | Google Scholar
Correll, C. U., Manu, P., Olshanskiy, V., Napolitano, B., Kane, J. M., Malhotra, A. K. (2009). Kardiometabolisk risk med andra generationens antipsykotiska läkemedel vid förstagångsanvändning hos barn och ungdomar. Jama 302, 1765-1773. doi: 10.1001/jama.2009.1549
PubMed Abstract | CrossRef Full Text | Google Scholar
Correll, C. U., Lencz, T., Malhotra, A. K. (2011). Antipsykotiska läkemedel och fetma. Trends Mol. Med. 17, 97-107. doi: 10.1016/j.molmed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., Lopez, M., Rahmouni, K. (2017). De cellulära och molekylära grunderna för leptin- och ghrelinresistens vid fetma. Nat. Rev. Endocrinol. 13, 338-351. doi: 10.1038/nrendo.2016.222
PubMed Abstract | CrossRef Full Text | Google Scholar
Dalvi, P. S., Chalmers, J. A., Luo, V., Han, D. Y., Wellhauser, L., Liu, Y., et al. (2017). Hög fetthalt inducerar akut och kronisk inflammation i hypotalamus: effekt av högfettkost, palmitat och TNF-alfa på aptitreglerande NPY-neuroner. Int. J. Obes. (Lond) 41, 149-158. doi: 10.1038/ijo.2016.183
PubMed Abstract | CrossRef Full Text | Google Scholar
Das-Munshi, J., Chang, C.-K., Dutta, R., Morgan, C., Nazroo, J., Stewart, R., et al. (2017). Etnicitet och överdödlighet vid allvarlig psykisk sjukdom: en kohortstudie. Lancet Psychiatry 4, 389-399. doi: 10.1016/S2215-0366(17)30097-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Fekadu, A., Medhin, G., Kebede, D., Alem, A., Cleare, A. J., Prince, M., et al. (2015). Överdödlighet vid allvarlig psykisk sjukdom: 10-årig befolkningsbaserad kohortstudie på den etiopiska landsbygden. Br. J. Psychiatry 206, 289-296. doi: 10.1192/bjp.bp.114.149112
PubMed Abstract | CrossRef Full Text | Google Scholar
Fountaine, R. J., Taylor, A. E., Mancuso, J. P., Greenway, F. L., Byerley, L. O., Smith, S. R., et al. (2010). Ökat födointag och ökad energiförbrukning efter administrering av olanzapin till friska män. Obesity 18, 1646-1651. doi: 10.1038/oby.2010.6
PubMed Abstract | CrossRef Full Text | Google Scholar
G.A.o.t.W.M. Association (2013). Världsmedicinska föreningens Helsingforsdeklaration: etiska principer för medicinsk forskning som involverar människor. JAMA 10 (20) 2191-2194. doi: 10.1001/jama.2013.281053
CrossRef Full Text | Google Scholar
Gothelf, D., Falk, B., Singer, P., Kairi, M., Phillip, M., Zigel, L., et al. (2002). Viktökning i samband med ökat matintag och låga vanliga aktivitetsnivåer hos manliga tonåriga schizofrena slutenvårdspatienter som behandlas med olanzapin. Am. J. Psychiatry 159, 1055-1057. doi: 10.1176/appi.ajp.159.6.1055
PubMed Abstract | CrossRef Full Text | Google Scholar
Henderson, D. C., Vincenzi, B., Andrea, N. V., Ulloa, M., Copeland, P. M. (2015). Patofysiologiska mekanismer för ökad kardiometabolisk risk hos personer med schizofreni och andra allvarliga psykiska sjukdomar. Lancet Psychiatry 2, 452-464. doi: 10.1016/S2215-0366(15)00115-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillebrand, J. J., van Elburg, A. A., Kas, M. J., van Engeland, H., Adan, R. A. (2005). Olanzapin minskar den fysiska aktiviteten hos råttor som utsätts för aktivitetsbaserad anorexi: möjliga konsekvenser för behandling av anorexia nervosa? Biol. Psychiatry 58, 651-657.
PubMed Abstract | Google Scholar
Hu, D.-Y. (2017). Nya riktlinjer och bevis för förebyggande och behandling av dyslipidemi och aterosklerotisk kardiovaskulär sjukdom i Kina. Chronic Dis. Trans. Med. 3, 73. doi: 10.1016/j.cdtm.2016.11.001
CrossRef Full Text | Google Scholar
Huhn, M., Nikolakopoulou, A., Schneider-Thoma, J., Krause, M., Samara, M., Peter, N., et al. (2019). Jämförande effekt och tolerabilitet av 32 orala antipsykotika för akut behandling av vuxna med multiepisodisk schizofreni: en systematisk översikt och nätverksmetaanalys. Lancet 394 (10202), 939-951. doi: 10.1016/S0140-6736(19)31135-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Kafantaris, V., Leigh, E., Hertz, S., Berest, A., Schebendach, J., Sterling, W. M., et al. (2011). En placebokontrollerad pilotstudie av kompletterande olanzapin för ungdomar med anorexia nervosa. J. Child Adolesc. Psychopharmacol. 21, 207-212. doi: 10.1089/cap.2010.0139
PubMed Abstract | CrossRef Full Text | Google Scholar
Kanders, B., Forse, R., Blackburn, G. (1991). Metoder inom fetma. Conn ”s Current Therapy. Ed. Rakel, R. E. (Philadelphia: WB Saunders), 524-532.
Google Scholar
Kluge, M., Schuld, A., Himmerich, H., Dalal, M., Schacht, A., Wehmeier, P. M., et al. (2007). Clozapine and olanzapine are associated with food craving and binge eating: results from a randomized double-blind study. J. Clin. Psychopharmacol. 27, 662-666. doi: 10.1097/jcp.0b013e31815a8872
PubMed Abstract | CrossRef Full Text | Google Scholar
Koopmann, A., von der Goltz, C., Grosshans, M., Dinter, C., Vitale, M., Wiedemann, K., et al. (2012). Sambandet mellan den aptitliga peptiden acetylerat ghrelin och alkoholbegär hos tidigt abstinenta alkoholberoende personer. Psychoneuroendocrinology 37, 980-986. doi: 10.1016/j.psyneuen.2011.11.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Corves, C., Arbter, D., Engel, R. R., Li, C., Davis, J. M. (2009). Andra generationens kontra första generationens antipsykotiska läkemedel för schizofreni: en metaanalys. Lancet 373, 31-41. doi: 10.1016/S0140-6736(08)61764-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Cipriani, A., Spineli, L., Mavridis, D., Orey, D., Richter, F., et al. (2013). Jämförande effekt och tolerabilitet av 15 antipsykotiska läkemedel vid schizofreni: en metaanalys med flera behandlingar. Lancet 382, 951-962. doi: 10.1016/S0140-6736(13)60733-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lieberman, J. A., Stroup, T. S., McEvoy, J. P., Swartz, M. S., Rosenheck, R. A., Perkins, D. O., et al. (2005). Effektivitet av antipsykotiska läkemedel hos patienter med kronisk schizofreni. New Engl. J. Med. 353, 1209-1223. doi: 10.1056/NEJMoa051688
CrossRef Full Text | Google Scholar
Lowette, K., Roosen, L., Tack, J., Vanden Berghe, P. (2015). Effekter av kost med hög fruktos på central aptitsignalering och kognitiv funktion. Front. Nutr. 2, 5. doi: 10.3389/fnut.2015.00005
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, M. L., Wang, T. N., Lin, T. Y., Shao, W. C., Chang, S. H., Chou, J. Y., et al. (2015). Differentiella effekter av olanzapin och klozapin på plasmanivåer av adipocytokiner och totalt ghrelin. Prog. Neuropsychopharmacol. Biol. Psychiatry 58, 47-50.
PubMed Abstract | Google Scholar
Mancuso, C., Izquierdo, A., Slattery, M., Becker, K. R., Plessow, F., Thomas, J. J., et al. (2019). Förändringar i aptitreglerande hormoner efter matintag är associerade med förändringar i rapporterad aptit och ett mått på hedoniskt ätande hos flickor och unga kvinnor med anorexia nervosa. Psychoneuroendocrinology 113, 104556. doi: 10.1016/j.psyneuen.2019.104556
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, J. P., Lieberman, J. A., Perkins, D. O., Hamer, R. M., Gu, H., Lazarus, A., et al. (2007). Effekt och tolerabilitet av olanzapin, quetiapin och risperidon vid behandling av tidig psykos: en randomiserad, dubbelblind 52-veckors jämförelse. Am. J. Psychiatry 164, 1050-1060. doi: 10.1176/ajp.2007.164.7.1050
PubMed Abstract | CrossRef Full Text | Google Scholar
Murashita, M., Kusumi, I., Inoue, T., Takahashi, Y., Hosoda, H., Kangawa, K., et al. (2005). Olanzapin ökar plasmanivån av ghrelin hos patienter med schizofreni. Psychoneuroendocrinology 30, 106-110. doi: 10.1016/j.psyneuen.2004.05.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Newcomer, J. W. (2006). Medicinsk risk hos patienter med bipolär sjukdom och schizofreni. J. Clin. Psychiatry 67, e16. doi: 10.4088/JCP.1106e16
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, M. Ø., Rostrup, E., Wulff, S., Glenthøj, B., Ebdrup, B. H. (2016). Striatal belöningsaktivitet och antipsykotika-associerad viktförändring hos patienter med schizofreni som genomgår initial behandling. JAMA Psychiatry 73, 121-128. doi: 10.1001/jamapsychiatry.2015.2582
PubMed Abstract | CrossRef Full Text | Google Scholar
Pawlowski, M., Abshir-Ahmed, Y., Beitinger, P., Steiger, A. (2018). S241. Undersökning av mekanismen för ökad aptit efter Olanzapin med sLORETA under sömn. Biol. Psychiatry 83, S441-S442.
Google Scholar
Perez-Cruzado, D., Cuesta-Vargas, A., Vera-Garcia, E., Mayoral-Cleries, F. (2018). Medicinering och fysisk aktivitet och fysisk kondition vid svår psykisk sjukdom. Psychiatry Res. 267, 19-24. doi: 10.1016/j.psychres.2018.05.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Poyurovsky, M., Fuchs, C., Pashinian, A., Levi, A., Faragian, S., Maayan, R., et al. (2007). Dämpande effekt av reboxetin på aptit och viktökning hos olanzapinbehandlade schizofrenipatienter: en dubbelblind placebokontrollerad studie. Psychopharmacology 192, 441-448. doi: 10.1007/s00213-007-0731-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Roerig, J. L., Mitchell, J. E., de Zwaan, M., Crosby, R. D., Gosnell, B. A., Steffen, K. J., et al. (2005). En jämförelse av effekterna av olanzapin och risperidon jämfört med placebo på ätbeteenden. J. Clin. Psychopharmacol. 25, 413-418. doi: 10.1097/01.jcp.0000177549.36585.29
PubMed Abstract | CrossRef Full Text | Google Scholar
Sentissi, O., Epelbaum, J., Olie, J. P., Poirier, M. F. (2008). Leptin- och ghrelinnivåer hos patienter med schizofreni under olika antipsykotikabehandlingar: en genomgång. Schizophr. Bull. 34, 1189-1199. doi: 10.1093/schbul/sbm141
PubMed Abstract | CrossRef Full Text | Google Scholar
Stip, E., Lungu, O. V., Anselmo, K., Letourneau, G., Mendrek, A., Stip, B., et al. (2012). Neurala förändringar i samband med behandling av aptitinformation hos schizofrena patienter efter 16 veckors olanzapinbehandling. Transl. Psychiatry 2, e128. doi: 10.1038/tp.2012.53
PubMed Abstract | CrossRef Full Text | Google Scholar
Sweeney, P., Li, C., Yang, Y. (2017). Aptitdämpande roll för mediala septala glutamatergiska neuroner. Proc. Natl. Acad. Sci. 114, 13816-13821. doi: 10.1073/pnas.1707228114
CrossRef Full Text | Google Scholar
Tan, L., Liu, J., Liu, X., Chen, J., Yan, Z., Yang, H., et al. (2009). Klinisk forskning om Olanzapin för förebyggande av kemoterapiinducerat illamående och kräkningar. J. Exp. Clin. Cancer Res. 28, 131. doi: 10.1186/1756-9966-28-131
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R.-R., Zhao, J.-P., Jin, H., Shao, P., Fang, M.-S., Guo, X.-F., et al. (2008). Livsstilsintervention och metformin för behandling av antipsykotikainducerad viktökning: en randomiserad kontrollerad studie. Jama 299, 185-193. doi: 10.1001/jama.2007.56-b
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R., Zhang, F., Gao, K., Ou, J., Shao, P., Jin, H., et al. (2016). Metforminbehandling av antipsykotikainducerad dyslipidemi: en analys av två randomiserade, placebokontrollerade studier. Mol. Psychiatry 21, 1537. doi: 10.1038/mp.2015.221
PubMed Abstract | CrossRef Full Text | Google Scholar




