Polyester
Syntesen av polyestrar uppnås i allmänhet genom en polykondensationsreaktion. Se ”kondensationsreaktioner i polymerkemi”.Den allmänna ekvationen för reaktionen av en diol med en diacid är :
(n+1) R(OH)2 + n R´(COOH)2 → HOnROH + 2n H2O.
Polyestrar kan erhållas genom ett stort antal reaktioner av vilka de viktigaste är reaktionen mellan syror och alkoholer, alkoholys och/eller acidolys av estrar med låg molekylvikt eller alkoholys av acylklorider. Följande figur ger en översikt över sådana typiska polykondensationsreaktioner för polyestertillverkning. Dessutom är polyestrar tillgängliga via ringöppningspolymerisering.

AzeotroppförestringRedigera
I denna klassiska metod reagerar en alkohol och en karboxylsyra för att bilda en karboxylsyra.För att sammanfoga en polymer måste vattnet som bildas vid reaktionen kontinuerligt avlägsnas genom azeotroppdestillation.
SmältförestringEdit
När monomerernas smältpunkter är tillräckligt låga kan en polyester bildas genom direkt förestring samtidigt som reaktionsvattnet avlägsnas via vakuum.
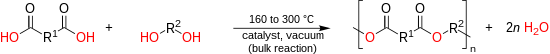
Direkt bulkpolyesterifikering vid höga temperaturer (150 – 290 °C) är väl lämpad och används i industriell skala för framställning av alifatiska polyestrar, omättade polyestrar och aromatiska-aliphatiska polyestrar. Monomerer som innehåller fenoliska eller tertiära hydroxylgrupper uppvisar en låg reaktivitet med karboxylsyror och kan inte polymeriseras via direkt syraalkoholbaserad polyesterifiering. När det gäller PET-tillverkning har dock den direkta processen flera fördelar, särskilt en högre reaktionshastighet, en högre uppnådd molekylvikt, frigörande av vatten i stället för metanol och lägre lagringskostnader för syran jämfört med estern på grund av den lägre vikten.
Alkoholisk transesterifieringRedigera

Transesterifiering: En oligomer med alkoholterminering och en oligomer med esterterminering kondenserar för att bilda en esterbindning, med förlust av en alkohol. R och R’ är de två oligomerkedjorna, R”’ är en offerenhet, t.ex. en metylgrupp (metanol är biprodukten av förestringsreaktionen).
Tecknet transesterifikation används vanligen för att beskriva utbytesreaktioner mellan hydroxi-ester, carboxy-ester och ester-ester. Hydroxi-esterutbytesreaktionen har den högsta reaktionshastigheten och används för framställning av många aromatisk-aliphatiska och helt aromatiska polyestrar. Den transesterifieringsbaserade syntesen är särskilt användbar när högsmältande och svårlösliga dikarboxylsyror används. Dessutom är alkoholer som kondensationsprodukt mer flyktiga och därmed lättare att avlägsna än vatten.
Hög temperatur smältsyntesen mellan bisfenoldiacetater och aromatiska dikarboxylsyror eller omvänt mellan bisfenoler och aromatiska dikarboxylsyredifenylestrar (utförd vid 220-320 °C med frigörande av ättiksyra) är, förutom den acylkloridbaserade syntesen, den föredragna vägen för att få fram helaromatiska polyestrar.
AcyleringRedigera
Vid acylering börjar syran som en syraklorid, och därför fortsätter polykondenseringen med utsläpp av saltsyra (HCl) i stället för vatten.
Reaktionen mellan diacylklorider och alkoholer eller fenolföreningar har tillämpats i stor utsträckning för polyestersyntes och har varit föremål för många översikter och bokkapitel. Reaktionen utförs vid lägre temperaturer än jämviktsmetoderna; tänkbara typer är lösningskondensation vid hög temperatur, aminkatalyserade reaktioner och gränsytereaktioner. Dessutom räknas användningen av aktiveringsmedel som en icke-jämviktsmetod. Jämviktskonstanterna för den acylkloridbaserade kondensationen som ger arylater och polyarylater är mycket höga och rapporteras vara 4,3 × 103 respektive 4,7 × 103. Denna reaktion kallas därför ofta för en polyesterifiering som inte är i jämvikt. Även om den acylkloridbaserade syntesen också är föremål för rapporter i patentlitteraturen är det osannolikt att reaktionen används i produktionsskala. Metoden begränsas av syredikloridernas höga kostnad, dess känslighet för hydrolys och förekomsten av sidoreaktioner.
Högtemperaturreaktionen (100 till > 300 °C) av en diacylklorid med en dialkohol ger polyester och väteklorid. Vid dessa relativt höga temperaturer går reaktionen snabbt utan katalysator:

Omsättningen av reaktionen kan följas genom titrering av den utvecklade vätekloriden. En mängd olika lösningsmedel har beskrivits, bland annat klorerade bensenar (t.ex. diklorbensen), klorerade naftalener eller difenyls, samt icke-klorerade aromatiska ämnen som terfenyls, bensofenoner eller dibenzylbenzener. Reaktionen har också använts framgångsrikt för att framställa högkristallina och svårlösliga polymerer som kräver höga temperaturer för att hållas i lösning (åtminstone tills en tillräckligt hög molekylvikt har uppnåtts).
I en interfacial acylkloridbaserad reaktion löses alkoholen (i allmänhet i själva verket en fenol) i form av en alkoxid i en vattenhaltig natriumhydroxidlösning, acylkloriden i ett organiskt lösningsmedel som inte är blandbart med vatten, t.ex. diklormetan, klorbenzen eller hexan, och reaktionen sker vid gränsytan under höghastighetsomrörning nära rumstemperatur.

Förfarandet används för framställning av polyarylater (polyestrar baserade på bisfenoler), polyamider, polykarbonater, poly(tiokarbonater) och andra. Eftersom molekylvikten hos den produkt som erhålls genom en syntes vid hög temperatur kan begränsas allvarligt av sidoreaktioner, kringgås detta problem genom de milda temperaturerna vid interfacial polykondensering. Förfarandet tillämpas för kommersiell produktion av bisfenol-A-baserade polyarylater som Unitikas U-Polymer. Vatten kan i vissa fall ersättas med ett oblandbart organiskt lösningsmedel (t.ex. i systemet adiponitril/koltetraklorid). Förfarandet är föga användbart vid framställning av polyestrar baserade på alifatiska dioler som har högre pKa-värden än fenoler och därför inte bildar alkoholatjoner i vattenlösningar. Den baskatalyserade reaktionen av en acylklorid med en alkohol kan också utföras i en fas med tertiära aminer (t.ex. trietylamin, Et3N) eller pyridin som syraacceptorer:
Och även om acylkloridbaserade polyesterifieringar går mycket långsamt framåt vid rumstemperatur utan katalysator, påskyndar aminen reaktionen på flera möjliga sätt, även om mekanismen inte är helt klarlagd. Det är dock känt att tertiära aminer kan orsaka sidoreaktioner såsom bildning av ketener och ketendimerer.
Silylmetoden I denna variant av HCl-metoden, omvandlas karboxylsyrekloriden med trimetylsilyletern från alkoholkomponenten och produktion av trimetylsilylklorid erhålls
Acetatmetoden (förestring)Edit

Silylacetatmetoden
RingöppningspolymeriseringEdit

Alifatiska polyestrar kan sättas samman från laktoner under mycket milda förhållanden, katalyseras anioniskt, katjoniskt, metallorganiskt eller enzymbaserat Ett antal katalytiska metoder för sampolymerisering av epoxider med cykliska anhydrider har också nyligen visat sig ge ett brett spektrum av funktionaliserade polyestrar, både mättade och omättade. Ringöppningspolymerisering av laktoner och laktider tillämpas också i industriell skala.
Andra metoderEdit
Numera andra reaktioner har rapporterats för syntesen av utvalda polyestrar, men är begränsade till synteser i laboratorieskala under specifika förhållanden, t.ex. med hjälp av dikarboxylsyresalter och dialkylhalogenider eller reaktioner mellan bisketener och dioler.
Istället för acylklorider kan så kallade aktiveringsmedel användas, till exempel 1,1′-karbonyldiimidazol, dicyklohexylkarbodiimid eller trifluoroättikanhydrid. Polykondensationen sker genom in situ-omvandling av karboxylsyran till en mer reaktiv intermediär medan aktiveringsmedlen förbrukas. Reaktionen går till exempel via en intermediär N-acylimidazol som reagerar med katalytiskt verkande natriumalkoxid:

Användningen av aktiveringsmedel för framställning av högsmältande aromatiska polyestrar och polyamider under milda förhållanden har varit föremål för intensiv akademisk forskning sedan 1980-talet, men reaktionerna har inte vunnit kommersiell acceptans eftersom liknande resultat kan uppnås med billigare reaktanter.
Termodynamik för polykondensationsreaktionerEdit
Polyesterifieringar grupperas av vissa författare i två huvudkategorier: a) polyesterifieringar i jämvikt (huvudsakligen alkohol-syra-reaktioner, alkohol-ester- och syra-ester-utbytesreaktioner, som utförs i bulk vid höga temperaturer), och b) polyesterifieringar som inte är i jämvikt, där man använder starkt reaktiva monomerer (t.ex. syraklorider eller aktiverade karbonsyror, som huvudsakligen utförs vid lägre temperaturer i lösning).
Den syra-alkoholbaserade polyesterifieringen är ett exempel på en jämviktsreaktion. Förhållandet mellan den polymerbildande estergruppen (-C(O)O-) och kondensationsprodukten vatten (H2O) mot de syrabaserade (-C(O)OH) och alkoholbaserade (-OH) monomerer beskrivs av jämviktskonstanten KC.
K C = {\displaystyle K_{C}={\frac {}{}}}}}

Gjämviktskonstanten för den syra-alkoholbaserade polyesterifieringen är vanligtvis KC ≤ 10, vilket inte är tillräckligt högt för att erhålla polymerer med hög molekylvikt (DPn ≥ 100), eftersom den antalsmässiga genomsnittliga polymerisationsgraden (DPn) kan beräknas från jämviktskonstanten KC.
D P n = K C 2 + 1 {\displaystyle DP_{n}~=~{{\sqrt{K_{C}}}+1}

I jämviktsreaktioner är det därför nödvändigt att kontinuerligt och effektivt avlägsna kondensationsprodukten från reaktionsmediet för att driva jämvikten mot polymer. Kondensationsprodukten avlägsnas därför vid reducerat tryck och höga temperaturer (150-320 °C, beroende på monomererna) för att förhindra en backreaktion. När reaktionen fortskrider minskar koncentrationen av aktiva kedjeändar och smältans eller lösningens viskositet ökar. För att öka reaktionshastigheten utförs reaktionen vid hög koncentration av ändgrupper (företrädesvis i bulk), vilket främjas av de förhöjda temperaturerna.
Jämviktskonstanter av storleksordningen KC ≥ 104 uppnås vid användning av reaktiva reaktanter (syraklorider eller syraanhydrider) eller aktiveringsmedel som 1,1′-carbonyldiimidazol. Med hjälp av dessa reaktanter kan molekylvikter som krävs för tekniska tillämpningar uppnås även utan aktivt avlägsnande av kondensationsprodukten.




