6.17: Polyatomaire ionen
Onze bespreking van ionische verbindingen was beperkt tot mono-atomaire ionen. Complexere ionen, die meerdere atomen bevatten die covalent aan elkaar gebonden zijn, maar die een positieve of negatieve lading hebben, komen echter vrij vaak voor in de chemie. De lading ontstaat omdat het totale aantal valentie-elektronen van de atomen geen stabiele structuur kan opleveren. Door één of meer elektronen toe te voegen of te verwijderen, ontstaat een stabiele structuur. Bekende voorbeelden van dergelijke polyatomische ionen zijn het sulfaation (SO42-),
het hydroxide-ion (OH-),
het hydronium-ion (H3O+),
en het ammonium-ion (NH4+).
De atomen in deze ionen zijn met elkaar verbonden door covalente elektronen-paar bindingen, en we kunnen Lewisstructuren tekenen voor de ionen net zoals we dat kunnen voor moleculen. Het enige verschil is dat het aantal elektronen in het ion niet precies in evenwicht is met de som van de kernladingen. Ofwel zijn er te veel elektronen, in welk geval we een anion hebben, ofwel te weinig, in welk geval we een kation hebben.
Bedenk bijvoorbeeld het hydroxide-ion (OH-) waarvan de Lewisstructuur
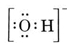
Een neutraal molecuul dat één O- en één H-atoom bevat, zou slechts zeven elektronen bevatten, zes van O en één van H. Het hydroxide-ion bevat echter een octet van elektronen, één meer dan het neutrale molecuul. Het hydroxide-ion moet dus een enkele negatieve lading hebben. Om de Lewisstructuur van een bepaald ion te tekenen, moeten we eerst bepalen hoeveel valentie-elektronen erbij betrokken zijn. Stel dat de structuur van H3O+ nodig is. Het totaal aantal elektronen wordt verkregen door de valentie-elektronen van elk atoom op te tellen, 6 + 1 + 1 + 1 = 9 elektronen. Nu moet er 1 elektron worden afgetrokken, want het gaat niet om H3O maar om H3O+. Het totaal aantal elektronen is dus 9 – 1 = 8. Aangezien dit een octet van elektronen is, kunnen we ze allemaal rond het O-atoom plaatsen. De uiteindelijke structuur volgt dan heel gemakkelijk:
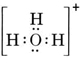
In meer gecompliceerde gevallen is het vaak nuttig om het aantal gedeelde elektronenparen te berekenen alvorens een Lewisstructuur te tekenen. Dit is met name het geval wanneer het ion in kwestie een oxyanion is (d.w.z. een centraal atoom is omgeven door meerdere O-atomen). Een bekend oxyanion is het carbonaation, dat de formule CO32- heeft. (Merk op dat het centrale atoom C eerst wordt geschreven, zoals eerder werd gedaan voor moleculen). Het totaal aantal valentie-elektronen beschikbaar in CO32- is 9556> 8181 + 3 maal 6 valentie-elektronen (voor O)
We moeten deze elektronen over 4 atomen verdelen, dus elk een octet, wat 4 × 8 = 32 elektronen betekent. Dit betekent dat 32 – 24 = 8 elektronen twee keer geteld moeten worden voor het octet; d.w.z. dat 8 elektronen gedeeld worden. Het a-ion bevat dus vier elektronen-paar bindingen. Vermoedelijk is het C-atoom dubbel gebonden aan één van de O’s en enkel gebonden aan de andere twee:
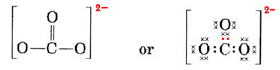
In dit diagram zijn de 4C-elektronen weergegeven door stippen, de 18 O-elektronen door ×’s, en de 2 extra elektronen door gekleurde stippen, om ze gemakkelijk te kunnen terugvinden. Echte elektronen dragen geen labels als deze; ze zijn allemaal hetzelfde.
Er is een ernstig bezwaar tegen de zojuist getekende Lewis-structuur. Hoe weten de elektronen welk zuurstofatoom ze eruit moeten halen om er een dubbele binding mee te vormen, aangezien er verder niets is om de oxygenen van elkaar te onderscheiden? Het antwoord is dat ze dat niet weten. Om de binding in het CO32-ion en sommige andere moleculen te verklaren is een uitbreiding van de Lewis-theorie nodig. We gaan hier verder op in wanneer we resonantie bespreken. We eindigen met een voorbeeld.
Voorbeeld : Lewisstructuur
Teken een Lewisstructuur voor het sulfietion, SO32-.
Oplossing De veiligste methode hier is om elektronen te tellen. Het totaal aantal valentie-elektronen dat beschikbaar is, is
6(voor S) + 3 × 6(voor O) + 2(voor de lading) = 26Om vier octetten te maken voor de vier atomen zijn 32 elektronen nodig, en dus geeft het verschil, 32 – 26 = 6, het aantal gedeelde elektronen. Er zijn dus slechts drie elektronen-paarbindingen in het ion. Het centrale S-atoom moet door een enkele binding met elk O-atoom verbonden zijn.
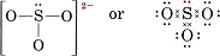
Merk op dat elk van de S-O-bindingen coördinaatcovalent is.
Bijdragers
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.




