6.17: Víceatomové ionty
Naše diskuse o iontových sloučeninách se omezila na jednoatomové ionty. V chemii se však poměrně často vyskytují složitější ionty, které obsahují několik atomů vzájemně kovalentně vázaných, ale mají kladný nebo záporný náboj. Náboj vzniká proto, že celkový počet valenčních elektronů z atomů nemůže vytvořit stabilní strukturu. Přidáním nebo odebráním jednoho nebo více elektronů vznikne stabilní struktura. Známými příklady takových víceatomových iontů jsou síranový ion (SO42-),
hydroxidový ion (OH-),
vodíkový ion (H3O+),
a amonný ion (NH4+).
Atomy v těchto iontech jsou spojeny kovalentními elektronovými párovými vazbami a pro ionty můžeme nakreslit Lewisovy struktury stejně jako pro molekuly. Jediný rozdíl je v tom, že počet elektronů v iontu nevyrovnává přesně součet jaderných nábojů. Buď je elektronů příliš mnoho, a v tom případě máme aniont, nebo příliš málo, a v tom případě máme kationt.
Považte například hydroxidový ion (OH-), pro který je Lewisova struktura
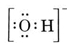
Neutrální molekula obsahující jeden atom O a jeden H by obsahovala pouze sedm elektronů, šest z O a jeden z H. Hydroxidový ion však obsahuje oktet elektronů, o jeden více než neutrální molekula. Hydroxidový iont tedy musí nést jeden záporný náboj. Abychom mohli nakreslit Lewisovu strukturu pro daný ion, musíme nejprve určit, kolik valenčních elektronů se na ní podílí. Předpokládejme, že potřebujeme strukturu H3O+. Celkový počet elektronů získáme sečtením valenčních elektronů pro každý atom, tedy 6 + 1 + 1 + 1 = 9 elektronů. Nyní musíme odečíst 1 elektron, protože uvažovaný druh není H3O, ale H3O+. Celkový počet elektronů je tedy 9 – 1 = 8. Protože se jedná o oktet elektronů, můžeme je umístit všude kolem atomu O. Výsledná struktura pak vyplývá velmi snadno:
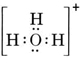
V komplikovanějších případech je často užitečné před nakreslením Lewisovy struktury vypočítat počet sdílených elektronových párů. To platí zejména tehdy, když je daný iont oxyaniontem (tj. centrální atom je obklopen několika atomy O). Dobře známým oxyaniontem je uhličitanový ion, který má vzorec CO32-. (Všimněte si, že centrální atom C se píše jako první, jak tomu bylo dříve u molekul.) Celkový počet valenčních elektronů, které má CO32- k dispozici, je
\( 4 \text{(pro C)} + 3 \krát 6 \text{(pro O)}. + 2 \text{(pro náboj -2)} = 24 \)
Tyto elektrony musíme rozdělit mezi 4 atomy, čímž každý z nich získá oktet, tedy 4 × 8 = 32 elektronů. To znamená, že 32 – 24 = 8 elektronů je třeba pro účely oktetu započítat dvakrát, tj. 8 elektronů je společných. Ion a tedy obsahuje čtyři elektronové párové vazby. Předpokládá se, že atom C má dvojnou vazbu s jedním z O a jednoduchou vazbu se zbylými dvěma:
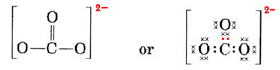
V tomto diagramu byly elektrony 4C znázorněny tečkami, 18 elektronů O × a 2 elektrony navíc barevnými tečkami pro účely snadné orientace. Skutečné elektrony nemají takové označení; všechny jsou stejné.
K právě nakreslené Lewisově struktuře existuje vážná námitka. Jak elektrony poznají, který atom kyslíku mají vyčlenit a vytvořit s ním dvojnou vazbu, když jinak oxygeny nic nerozlišuje? Odpověď zní, že ne. Vysvětlení vazby v iontu CO32- a některých dalších molekul vyžaduje rozšíření Lewisovy teorie. Touto otázkou se budeme dále zabývat, až budeme diskutovat o rezonanci. Nyní skončíme příkladem.
Příklad \(\PageIndex{1}\) : Lewisova struktura
Nakreslete Lewisovu strukturu pro siřičitanový ion, SO32-.
Roztok Nejbezpečnější metodou je zde počítání elektronů. Celkový počet dostupných valenčních elektronů je
6(pro S) + 3 × 6(pro O) + 2(pro náboj) = 26Pro vytvoření čtyř oktetů pro čtyři atomy by bylo třeba 32 elektronů, a tak rozdíl 32 – 26 = 6 udává počet sdílených elektronů. V iontu jsou tedy pouze tři elektronové párové vazby. Centrální atom S musí být spojen jednou vazbou s každým atomem O.
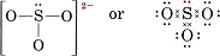
Všimněte si, že každá z vazeb S-O je souřadnicová kovalentní.
Přispěvatelé
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff a Adam Hahn
.




