6.17: Ionii poliatomici
Discuția noastră despre compușii ionici s-a limitat la ionii monatomici. Cu toate acestea, ionii mai complecși, care conțin mai mulți atomi legați covalent unul de altul, dar care au o sarcină pozitivă sau negativă, apar destul de frecvent în chimie. Sarcina apare deoarece numărul total de electroni de valență de la atomi nu poate produce o structură stabilă. Dacă se adaugă sau se elimină unul sau mai mulți electroni, rezultă o structură stabilă. Exemple binecunoscute de astfel de ioni poliatomici sunt: ionul sulfat (SO42-),
, ionul hidroxid (OH-),
, ionul hidroniu (H3O+),
și ionul amoniu (NH4+).
Atomii din acești ioni sunt uniți între ei prin legături covalente de pereche de electroni și putem desena structuri Lewis pentru ioni la fel ca și pentru molecule. Singura diferență este că numărul de electroni din ion nu echilibrează exact suma sarcinilor nucleare. Fie sunt prea mulți electroni, caz în care avem un anion, fie prea puțini, caz în care avem un cation.
Considerați, de exemplu, ionul hidroxid (OH-) pentru care structura Lewis este
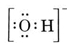
O moleculă neutră care conține un atom de O și unul de H ar conține doar șapte electroni, șase de la O și unul de la H. Ionul hidroxid, însă, conține un octet de electroni, cu unul mai mult decât molecula neutră. Prin urmare, ionul de hidroxid trebuie să poarte o singură sarcină negativă. Pentru a desena structura Lewis pentru un anumit ion, trebuie mai întâi să determinăm câți electroni de valență sunt implicați. Să presupunem că este necesară structura lui H3O+. Numărul total de electroni se obține prin însumarea electronilor de valență pentru fiecare atom, 6 + 1 + 1 + 1 + 1 = 9 electroni. Acum trebuie să scădem 1 electron, deoarece specia în cauză nu este H3O, ci H3O+. Numărul total de electroni este așadar 9 – 1 = 8. Deoarece este vorba de un octet de electroni, îi putem plasa în jurul atomului O. Structura finală rezultă atunci foarte ușor:
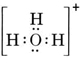
În cazuri mai complicate, este adesea util să se calculeze numărul de perechi de electroni comuni înainte de a desena o structură Lewis. Acest lucru este valabil mai ales atunci când ionul în cauză este un oxianion (adică, un atom central este înconjurat de mai mulți atomi de O). Un oxianion bine cunoscut este ionul carbonat, care are formula CO32-. (Rețineți că atomul central C este scris primul, așa cum s-a procedat mai devreme pentru molecule). Numărul total de electroni de valență disponibili în CO32- este
\( 4 \text{(pentru C)} + 3 \ ori 6 \text{(pentru O)} + 2 \text{(pentru sarcina -2)} = 24 \)
Trebuie să distribuim acești electroni pe 4 atomi, dând fiecăruia un octet, ceea ce înseamnă un necesar de 4 × 8 = 32 de electroni. Aceasta înseamnă că 32 – 24 = 8 electroni trebuie să fie numărați de două ori în scopul octetului; adică 8 electroni sunt împărțiți. Astfel, ionul a conține patru legături de perechi de electroni. Se presupune că atomul de C este dublu legat de unul dintre O și simplu legat de ceilalți doi:
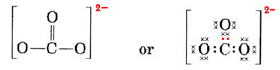
În această diagramă, cei 4 electroni de C au fost reprezentați prin puncte, cei 18 electroni de O prin ×, iar cei 2 electroni suplimentari prin puncte colorate, în scopul unei referințe ușoare. Electronii reali nu poartă astfel de etichete; ei sunt toți la fel.
Există o obiecție serioasă la structura Lewis tocmai desenată. Cum știu electronii ce atom de oxigen să selecteze și cu care să formeze o legătură dublă, din moment ce nu există altfel nimic care să diferențieze oxigenii? Răspunsul este că ei nu știu. Pentru a explica legătura din ionul CO32- și din alte câteva molecule este necesară o extindere a teoriei Lewis. Vom urmări această chestiune mai departe când vom discuta despre rezonanță. Acum încheiem cu un exemplu.
Exemplu \(\PageIndex{1}\) : Structura Lewis
Desenați o structură Lewis pentru ionul sulfit, SO32-.
Soluție Cea mai sigură metodă în acest caz este de a număra electronii. Numărul total de electroni de valență disponibili este
6(pentru S) + 3 × 6(pentru O) + 2(pentru sarcină) = 26Pentru a face patru octeți pentru cei patru atomi ar fi nevoie de 32 de electroni, și astfel diferența, 32 – 26 = 6, dă numărul de electroni comuni. Prin urmare, în ion există doar trei legături de perechi de electroni. Atomul S central trebuie să fie legat printr-o singură legătură de fiecare atom O.
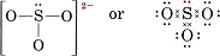
Rețineți că fiecare dintre legăturile S-O este covalentă de coordonate.
Contribuitori
-
Ed Vitz (Universitatea Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff și Adam Hahn.
.




