6.17: Fleratomige ioner
Vores diskussion om ionforbindelser var begrænset til monatomiske ioner. Mere komplekse ioner, der indeholder flere atomer, som er kovalent bundet til hinanden, men som har en positiv eller negativ ladning, forekommer imidlertid ret hyppigt i kemi. Ladningen opstår, fordi det samlede antal valenselektroner fra atomerne ikke kan give en stabil struktur. Hvis der tilføjes eller fjernes en eller flere elektroner, opstår der en stabil struktur. Velkendte eksempler på sådanne polyatomare ioner er sulfat-ionen (SO42-),
hydroxid-ionen (OH-),
hydronium-ionen (H3O+),
og ammonium-ionen (NH4+).
Atomerne i disse ioner er forbundet med hinanden ved kovalente elektronparbindinger, og vi kan tegne Lewis-strukturer for ionerne, ligesom vi kan tegne Lewis-strukturer for molekyler. Den eneste forskel er, at antallet af elektroner i ionen ikke nøjagtigt balancerer summen af atomladningerne. Enten er der for mange elektroner, i så fald har vi en anion, eller for få, i så fald har vi en kation.
Se f.eks. hydroxidionen (OH-), for hvilken Lewis-strukturen er
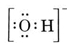
Et neutralt molekyle, der indeholder et O- og et H-atom, ville kun indeholde syv elektroner, seks fra O og en fra H. Hydroxidionen indeholder imidlertid en oktet af elektroner, en mere end det neutrale molekyle. Hydroxidionen må derfor bære en enkelt negativ ladning. For at kunne tegne Lewis-strukturen for en given ion skal vi først bestemme, hvor mange valenselektroner der er involveret. Lad os antage, at vi har brug for strukturen for H3O+. Det samlede antal elektroner fås ved at lægge valenselektronerne for hvert atom sammen, dvs. 6 + 1 + 1 + 1 + 1 = 9 elektroner. Nu skal der trækkes 1 elektron fra, da den pågældende art ikke er H3O, men H3O+. Det samlede antal elektroner er således 9 – 1 = 8. Da der er tale om en oktet af elektroner, kan vi placere dem alle omkring O-atomet. Den endelige struktur følger så meget let:
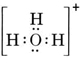
I mere komplicerede tilfælde er det ofte nyttigt at beregne antallet af delte elektronpar, før man tegner en Lewis-struktur. Dette gælder især, når den pågældende ion er en oxyanion (dvs. et centralt atom er omgivet af flere O-atomer). En velkendt oxyanion er carbonat-ionen, som har formlen CO32-. (Bemærk, at det centrale atom C skrives først, som det blev gjort tidligere for molekyler). Det samlede antal valenselektroner, der er til rådighed i CO32-, er
\( 4 \text{(for C)} + 3 \ gange 6 \text{(for O)} + 2 \text{(for -2-ladningen)} = 24 \)
Vi skal fordele disse elektroner på 4 atomer, så hvert atom får en oktet, hvilket giver et behov på 4 × 8 = 32 elektroner. Det betyder, at 32 – 24 = 8 elektroner skal tælles to gange med henblik på oktet, dvs. 8 elektroner deles. a-ionen indeholder således fire elektronparbindinger. Formentlig er C-atomet dobbeltbundet til et af O-atomerne og enkeltbundet til de to andre:
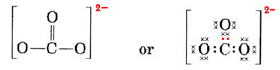
I dette diagram er de 4 C-elektroner repræsenteret med prikker, de 18 O-elektroner med ×’er og de 2 ekstra elektroner med farvede prikker, for at gøre det let at henvise til dem. De virkelige elektroner bærer ikke sådanne etiketter; de er alle ens.
Der er en alvorlig indvending mod den netop tegnede Lewis-struktur. Hvordan ved elektronerne, hvilket iltatom de skal udpege og danne en dobbeltbinding med, da der ellers ikke er noget, der adskiller iltatomerne fra hinanden? Svaret er, at det gør de ikke. For at forklare bindingerne i CO32-ionen og nogle andre molekyler er det nødvendigt med en udvidelse af Lewis-teorien. Vi forfølger dette spørgsmål yderligere, når vi diskuterer resonans. Nu slutter vi af med et eksempel.
Eksempel \(\PageIndex{1}\) : Lewisstruktur
Tegn en Lewisstruktur for sulfit-ionen, SO32-.
Løsning Den sikreste metode her er at tælle elektroner. Det samlede antal valenselektroner, der er til rådighed, er
6(for S) + 3 × 6(for O) + 2(for ladningen) = 26For at lave fire oktetter til de fire atomer ville det kræve 32 elektroner, og derfor giver forskellen, 32 – 26 = 6, antallet af delte elektroner. Der er således kun tre elektronparbindinger i ionen. Det centrale S-atom skal være forbundet med en enkelt binding til hvert O-atom.
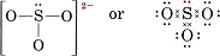
Bemærk, at hver af S-O-bindingerne er koordinatkovalente.
Bidragydere
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff og Adam Hahn.




