6.17: Polyatomare Ionen
Wir haben uns bei der Diskussion über ionische Verbindungen auf einatomige Ionen beschränkt. Komplexere Ionen, die mehrere Atome enthalten, die kovalent miteinander verbunden sind, aber eine positive oder negative Ladung haben, kommen in der Chemie jedoch recht häufig vor. Die Ladung entsteht, weil die Gesamtzahl der Valenzelektronen der Atome keine stabile Struktur ergeben kann. Wenn man ein oder mehrere Elektronen hinzufügt oder entfernt, entsteht eine stabile Struktur. Bekannte Beispiele für solche polyatomaren Ionen sind das Sulfat-Ion (SO42-),
das Hydroxid-Ion (OH-),
das Hydronium-Ion (H3O+),
und das Ammonium-Ion (NH4+).
Die Atome in diesen Ionen sind durch kovalente Elektronenpaarbindungen miteinander verbunden, und wir können Lewis-Strukturen für die Ionen genauso zeichnen wie für Moleküle. Der einzige Unterschied besteht darin, dass die Anzahl der Elektronen im Ion die Summe der Kernladungen nicht genau ausgleicht. Entweder gibt es zu viele Elektronen, dann haben wir ein Anion, oder zu wenige, dann haben wir ein Kation.
Betrachten wir zum Beispiel das Hydroxid-Ion (OH-), für das die Lewis-Struktur lautet
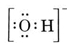
Ein neutrales Molekül, das ein O- und ein H-Atom enthält, würde nur sieben Elektronen enthalten, sechs von O und eines von H. Das Hydroxid-Ion enthält jedoch ein Oktett von Elektronen, eines mehr als das neutrale Molekül. Das Hydroxid-Ion muss also eine einzige negative Ladung tragen. Um die Lewis-Struktur für ein bestimmtes Ion zu zeichnen, müssen wir zunächst bestimmen, wie viele Valenzelektronen beteiligt sind. Angenommen, man benötigt die Struktur von H3O+. Die Gesamtzahl der Elektronen erhält man, indem man die Valenzelektronen für jedes Atom addiert: 6 + 1 + 1 + 1 = 9 Elektronen. Man muss nun 1 Elektron abziehen, da es sich nicht um H3O, sondern um H3O+ handelt. Die Gesamtzahl der Elektronen beträgt also 9 – 1 = 8. Da es sich um ein Oktett von Elektronen handelt, können wir sie alle um das O-Atom herum anordnen. Die endgültige Struktur ergibt sich dann ganz einfach:
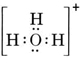
In komplizierteren Fällen ist es oft sinnvoll, die Anzahl der gemeinsamen Elektronenpaare zu berechnen, bevor man eine Lewis-Struktur zeichnet. Dies gilt insbesondere dann, wenn es sich bei dem betreffenden Ion um ein Oxyanion handelt (d. h. ein Zentralatom ist von mehreren O-Atomen umgeben). Ein bekanntes Oxyanion ist das Carbonat-Ion, das die Formel CO32- hat. (Man beachte, dass das Zentralatom C an erster Stelle steht, wie bereits bei den Molekülen). Die Gesamtzahl der Valenzelektronen in CO32- ist
\( 4 \text{(für C)} + 3 \times 6 \text{(für O)} + 2 \text{(für die -2-Ladung)} = 24 \)
Wir müssen diese Elektronen auf 4 Atome verteilen, wodurch jedes ein Oktett erhält, was 4 × 8 = 32 Elektronen erfordert. Das bedeutet, dass 32 – 24 = 8 Elektronen für das Oktett zweimal gezählt werden müssen, d.h. 8 Elektronen werden geteilt. Das a-Ion enthält also vier Elektronenpaarbindungen. Vermutlich ist das C-Atom an eines der O-Atome doppelt und an die beiden anderen einfach gebunden:
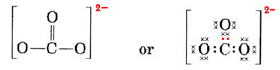
In diesem Diagramm wurden die 4 C-Elektronen durch Punkte, die 18 O-Elektronen durch × und die 2 zusätzlichen Elektronen durch farbige Punkte dargestellt, um die Orientierung zu erleichtern. Echte Elektronen tragen keine solchen Bezeichnungen; sie sind alle gleich.
Es gibt einen ernsthaften Einwand gegen die soeben gezeichnete Lewis-Struktur. Woher wissen die Elektronen, welches Sauerstoffatom sie herausnehmen und mit ihm eine Doppelbindung eingehen sollen, wenn es doch sonst nichts gibt, was die Sauerstoffatome voneinander unterscheidet? Die Antwort ist, dass sie es nicht wissen. Um die Bindungen im CO32-Ion und einigen anderen Molekülen zu erklären, ist eine Erweiterung der Lewis-Theorie erforderlich. Wir werden diese Frage weiter verfolgen, wenn wir die Resonanz diskutieren. Nun schließen wir mit einem Beispiel ab.
Beispiel \(\PageIndex{1}\) : Lewis-Struktur
Zeichne eine Lewis-Struktur für das Sulfit-Ion, SO32-.
Lösung Die sicherste Methode ist hier, die Elektronen zu zählen. Die Gesamtzahl der verfügbaren Valenzelektronen ist
6(für S) + 3 × 6(für O) + 2(für die Ladung) = 26Um vier Oktette für die vier Atome zu bilden, wären 32 Elektronen erforderlich, und die Differenz 32 – 26 = 6 ergibt die Anzahl der gemeinsam genutzten Elektronen. Es gibt also nur drei Elektronenpaarbindungen in dem Ion. Das zentrale S-Atom muss über eine Einfachbindung mit jedem O-Atom verbunden sein.
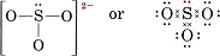
Beachten Sie, dass jede der S-O-Bindungen koordinativ kovalent ist.
Beitragende
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff und Adam Hahn.




