Verstöße gegen die Oktettregel
Ausnahme 2: Unvollständige Oktette
Die zweite Ausnahme von der Oktettregel liegt vor, wenn zu wenige Valenzelektronen vorhanden sind, was zu einem unvollständigen Oktett führt. Es gibt noch mehr Fälle, in denen die Oktettregel nicht die korrekteste Darstellung eines Moleküls oder Ions ergibt. Dies ist auch bei unvollständigen Oktetten der Fall. Arten mit unvollständigen Oktetten sind ziemlich selten und kommen im Allgemeinen nur bei einigen Beryllium-, Aluminium- und Borverbindungen einschließlich der Borhydride vor. Werfen wir einen Blick auf ein solches Hydrid, \(BH_3\) (Boran).
Wenn man eine Lewis-Struktur für \(BH_3\) nach den grundlegenden Strategien für das Zeichnen von Lewis-Strukturen erstellen würde, käme man wahrscheinlich zu dieser Struktur (Abbildung 3):
Das Problem bei dieser Struktur ist, dass Bor ein unvollständiges Oktett hat; es hat nur sechs Elektronen um sich herum. Wasserstoffatome können natürlich nur 2 Elektronen in ihrer äußersten Schale haben (ihre Version eines Oktetts), und daher gibt es keine freien Elektronen, um eine Doppelbindung mit Bor zu bilden. Man könnte vermuten, dass die Tatsache, dass diese Struktur kein vollständiges Oktett bilden kann, bedeutet, dass diese Bindung nicht kovalent, sondern ionisch sein muss. Bor hat jedoch eine Elektronegativität, die der von Wasserstoff sehr ähnlich ist, was bedeutet, dass die Wasserstoff-Bor-Bindung wahrscheinlich nur einen sehr geringen ionischen Charakter hat. Daher ist diese Lewis-Struktur, obwohl sie die Oktettregel nicht erfüllt, wahrscheinlich die bestmögliche Struktur zur Darstellung von BH3 mit der Lewis-Theorie. Einer der Gründe für das unvollständige Oktett von BH3 ist, dass es sich häufig um eine vorübergehende Spezies handelt, die vorübergehend in mehrstufigen Reaktionen gebildet wird.
Werfen wir einen Blick auf eine andere unvollständige Oktettsituation, die mit Bor zu tun hat, BF3 (Bortrifluorin). Wie bei BH3 ergibt die anfängliche Zeichnung einer Lewis-Struktur von BF3 eine Struktur, in der Bor nur sechs Elektronen um sich herum hat (Abbildung 4).
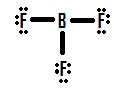
Wenn man sich Abbildung 4 ansieht, kann man erkennen, dass die Fluoratome zusätzliche einsame Paare besitzen, die sie nutzen können, um zusätzliche Bindungen mit Bor einzugehen, und man könnte meinen, dass man nur ein einsames Paar in eine Bindung umwandeln muss, damit die Struktur korrekt ist. Wenn wir eine Doppelbindung zwischen Bor und einem der Fluoratome hinzufügen, erhalten wir die folgende Lewis-Struktur (Abbildung 5):
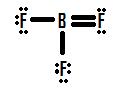
Jedes Fluoratom hat acht Elektronen, und das Boratom hat ebenfalls acht! Jedes Atom hat ein perfektes Oktett, richtig? Nicht so schnell. Wir müssen die formalen Ladungen dieser Struktur untersuchen. Das Fluoratom, das sich eine Doppelbindung mit dem Bor teilt, hat sechs Elektronen um sich herum (vier von seinen zwei einsamen Elektronenpaaren und je eines von seinen beiden Bindungen mit dem Bor). Das ist ein Elektron weniger als die Anzahl der Valenzelektronen, die es von Natur aus hätte (Elemente der Gruppe 7 haben sieben Valenzelektronen), so dass es eine formale Ladung von +1 hat. Die beiden Flourine, die sich Einfachbindungen mit Bor teilen, haben sieben Elektronen um sich herum (sechs von ihren drei einsamen Paaren und eines von ihren Einfachbindungen mit Bor). Dies entspricht der Anzahl der Valenzelektronen, die sie alleine hätten, so dass sie beide eine formale Ladung von Null haben. Bor schließlich hat vier Elektronen um sich herum (eines aus jeder seiner vier mit Fluor geteilten Bindungen). Dies ist ein Elektron mehr als die Anzahl der Valenzelektronen, die Bor alleine hätte, und daher hat Bor eine formale Ladung von -1.
Diese Struktur wird durch die Tatsache unterstützt, dass die experimentell ermittelte Bindungslänge der Bor-Fluor-Bindungen in BF3 geringer ist als für eine Einfachbindung typisch wäre (siehe Bindungsordnung und -längen). Diese Struktur widerspricht jedoch einer der wichtigsten Regeln für formale Ladungen: Negative formale Ladungen sollten auf dem/den elektronegativeren Atom(en) in einer Bindung zu finden sein, aber in der in Abbildung 5 dargestellten Struktur findet sich eine positive formale Ladung auf Fluor, das nicht nur das elektronegativste Element in der Struktur ist, sondern auch das elektronegativste Element im gesamten Periodensystem (\(\chi=4.0\)). Bor hingegen, mit einer viel geringeren Elektronegativität von 2,0, hat in dieser Struktur die negative formale Ladung. Diese Diskrepanz zwischen formaler Ladung und Elektronegativität macht diese Doppelbindungsstruktur unmöglich.
Der große Elektronegativitätsunterschied im Gegensatz zu BH3 deutet jedoch auf bedeutende polare Bindungen zwischen Bor und Fluor hin, was bedeutet, dass dieses Molekül einen hohen ionischen Charakter aufweist. Dies legt die Möglichkeit einer halbionischen Struktur nahe, wie sie in Abbildung 6 zu sehen ist:

Keine dieser drei Strukturen ist in diesem Fall die „richtige“ Struktur. Die „richtigste“ Struktur ist höchstwahrscheinlich eine Resonanz aller drei Strukturen: derjenigen mit dem unvollständigen Oktett (Abbildung 4), derjenigen mit der Doppelbindung (Abbildung 5) und derjenigen mit der Ionenbindung (Abbildung 6). Den größten Beitrag leistet wahrscheinlich die Struktur mit dem unvollständigen Oktett (da Abbildung 5 im Grunde unmöglich ist und Abbildung 6 nicht mit dem Verhalten und den Eigenschaften von BF3 übereinstimmt). Wie man sieht, können unvollständige Oktette eine Molekülstruktur am besten darstellen, selbst wenn andere Möglichkeiten bestehen.
Nebenbei bemerkt, ist es wichtig zu wissen, dass BF3 sich häufig mit einem F- Ion verbindet, um BF4- zu bilden, anstatt als BF3 zu bleiben. Diese Struktur vervollständigt das Oktett des Bors und ist in der Natur häufiger anzutreffen. Dies ist ein Beispiel dafür, dass unvollständige Oktette selten sind und andere Konfigurationen in der Regel günstiger sind, einschließlich der Bindung mit zusätzlichen Ionen wie im Fall von BF3.
Beispiel: \(BF_3\)
Zeichne die Lewis-Struktur für Bortrifluorid (BF3).
Lösung
1. Füge Elektronen (3*7) + 3 = 24
2. Zeichne Verbindungen:
3. Füge Oktette zu den äußeren Atomen hinzu:
4. Füge zusätzliche Elektronen (24-24=0) zum Zentralatom hinzu:
5. Hat das zentrale Elektron ein Oktett?
- Nein. Es hat 6 Elektronen
- Füge eine Mehrfachbindung (Doppelbindung) hinzu, um zu sehen, ob das zentrale Atom ein Oktett erreichen kann:
6. Das zentrale Bor hat jetzt ein Oktett (es gäbe drei Lewis-Resonanzstrukturen)
Allerdings…
- In dieser Struktur mit einer Doppelbindung teilt sich das Fluoratom zusätzliche Elektronen mit dem Bor.
- Das Fluor hätte eine „+“-Partialladung und das Bor eine „-„-Partialladung, was mit den Elektronegativitäten von Fluor und Bor unvereinbar ist.
- Daher ist die Struktur von BF3 mit Einfachbindungen und 6 Valenzelektronen um das zentrale Bor die wahrscheinlichste Struktur
- BF3 reagiert stark mit Verbindungen, die ein ungeteiltes Elektronenpaar haben, das zur Bildung einer Bindung mit dem Bor genutzt werden kann:




