心室性頻拍(VT)。 ECG criteria, causes, classification, treatment (management)
この章では、心室頻拍を臨床的観点から扱い、心電図診断、定義、管理、臨床的特徴に重点を置いている。 心室頻拍は心室から発生する非常にニュアンスの異なる不整脈である。 心室頻拍の原因となる疾患は多岐にわたり、心電図もそれらの疾患と同様に微妙に異なる。 病因や心電図にかかわらず、心室頻拍は常に生命を脅かす可能性のある不整脈であり、早急な対処が必要である。 心室速度は通常非常に速く(100-250拍/分)、ほぼすべての症例で心拍出量に影響(すなわち減少)がある。 心室頻拍は心室心筋に大きな負担をかけると同時に、不整脈の原因がすでに細胞機能に影響を及ぼしているため、心室心筋に大きな負担がかかります。 その結果、電気的に不安定になり、心室頻拍から心室細動に移行することがあります。 心室細動を放置すると、不全収縮や心停止に至る。 心室頻拍の原因
心室頻拍の患者は、職業に関係なく、ほぼ必ず重大な心臓疾患を基礎疾患として持っています。 最も一般的な原因は、冠動脈疾患(急性冠症候群または虚血性心疾患)、心不全、心筋症(拡張型心筋症、閉塞性肥大型心筋症)、弁膜症などである。 一般的ではない原因としては、不整脈原性右室心筋症・異形成(ARVC/ARVD)、ブルガダ症候群、QT延長症候群、サルコイドーシス、プリンツメタル狭心症(冠血管攣縮)、電解質異常、先天性心疾患、カテコラミンによる心室頻拍などが挙げられます。
心室頻拍の患者の大部分は、冠動脈疾患(虚血性心疾患)、心不全、心筋症、または心臓弁膜症のいずれかを持っています。 これらの集団において,心臓突然死の最も強力な予測因子の1つは左室機能である。 左室機能が低下している人(例:駆出率<40%と定義)は、突然の心停止のリスクが高い
特発性心室頻拍(IVT)
心室頻拍は、原因が特定できない場合は特発性に分類されることがあります。
心室頻拍のメカニズム
心室頻拍は、自動性、リエントリー、トリガー活動の増加または異常により発生することがあります。 この不整脈の発生と維持には、あらゆる種類の心筋細胞が関与している可能性がある。 前述のように、VTは血行動態を悪化させる。 急速な心拍数は、すでに低下した心室機能を伴っていることもあり、心室を十分に満たすことができず、その結果、一回拍出量が減少し、心拍出量が減少する。
不整脈が持続すると、ほとんどの患者は前兆や失神を経験する。 その劇症型経過では、VTは心室細動に変性し、その後、不全収縮と心停止に変性する。 重要なことは、VTから心停止への進行は、自然に、あるいは治療によって中断される可能性があることである。 興味深いことに、VTの治療は心臓病学において最も大きな進歩のひとつと考えられている。 1961年まで、急性心筋梗塞の患者は、患者の安静を妨げないように、医師や看護婦のいる場所から離れたベッドに寝かされていた。 医師や看護師がいるだけでストレスになると考えられていたのだ。 この病院では約30%の患者が死亡し、その主な原因は致死的な頻脈性不整脈であったと推定される。 1950年代後半、1960年、1961年に行われた動物実験では、電気ショックを与えることにより、VTを停止させることができることが示された。 そこで、急性心筋梗塞の全患者を連続心電図で監視し、心室性頻脈性不整脈には直ちに蘇生術と除細動を行う冠動脈治療室が建設されることになったのである。
急性冠症候群(心筋梗塞)における心室頻拍
急性冠症候群は、不安定狭心症(UA)、ST上昇心筋梗塞(STEMI)、非ST上昇心筋梗塞(NSTEMI)に細分化される。 これらの状態では、VTのリスクは高い。 さらに、そのリスクは時間依存性が高く、超急性期(症状発現後、数分から数時間)に最も高くなる。 心筋梗塞の急性期に死亡する人の大多数は、実は心室性頻脈性不整脈が原因である。 ポンプ機能不全(心原性ショック)による死亡はそれほど多くありません。 その危険性は最初の数分から数時間に最も高いので、ほとんどの死亡は病院の外で起こっている。 VT(ひいては心室細動)のリスクは時間が経つにつれて徐々に減少する。 時間に加えて、VTの主要な決定要因は虚血/梗塞の程度である。 虚血の程度が大きいほど不整脈のリスクは高くなります。
心室頻拍のECG基準
心室頻拍のECG特徴
- ≧3連続した心拍数100-250拍/分(多くの場合>120拍/分)。 心拍数100~120回/分の心室頻拍を徐脈性心室頻拍という。 心室頻拍のうち、心拍数が>250回/分のものを心室粗動といいます。
- 広いQRS複合(QRS時間≧0,12秒)
心室頻拍の種類
心電図では心室頻拍のサブクラス分けが可能です。 以下の議論は高度なものと思われるかもしれませんが、すべての臨床医が心室頻拍を分類できる必要はなく、単にそれを認識できれば十分であることを読者は知っておく必要があります。
持続性心室頻拍と非持続性心室頻拍
心室頻拍の持続時間が<30秒未満のものは非持続性心室頻拍として分類される。 持続性心室頻拍は、持続時間<8277>30秒である。
単形性心室頻拍
単形性心室頻拍では、すべてのQRS複合体が同じ形態を示す(微差は許容される)。 これは、インパルスが同じ異所性の焦点から発生していることを示す。 構造的な心臓病(冠動脈疾患、心不全、心筋症、弁膜症など)では、単形性心室頻拍は通常リエントリーによって引き起こされます。 図1参照
冠動脈疾患患者の心室頻拍には、心室中隔のプルキンエ線維が重要な役割を果たすようである。 これらのプルキンエ線維は、心筋虚血、特に再虚血の設定において、非常に不整脈を起こしやすいようである。 心室中隔で発生したインパルスは(ある程度)プルキンエネットワークに入るため、QRS複合体は自由心室壁で発生した不整脈よりも短くなる傾向がある。 心室中隔に発生する心室頻拍のQRS時間は一般に120~145msである
筋膜性心室頻拍は特発性のVTの一形態である。 左束枝の筋膜(すなわちプルキンエ線維)におけるリエントリーによって引き起こされる。 筋膜性心室頻拍は50歳未満で発症し、主に男性にみられます。 QRS複合は右脚ブロックに類似した形態を示し、左軸偏位を認める。
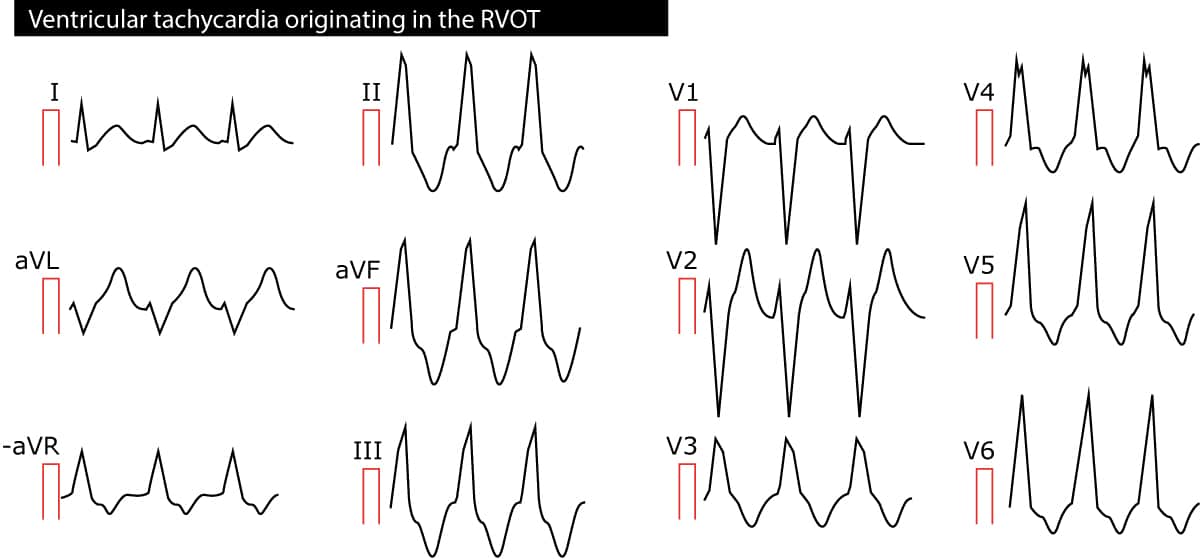
右室流出路型心室頻拍は、右室流出路に発生する単形性の心室頻拍で、左室流出路に発生する単形性の心室頻拍は、右室流出路に発生する単形性の心室頻拍である。 この不整脈はほとんどが特発性であるが、患者によってはARVC(不整脈源性右室心筋症)を有する場合がある。 インパルスは右心室から発生するため、QRS複合体は左束枝の外観を持ち、電気軸は90°前後である。 図2参照
多形性心室頻拍
QRS形態が変化する、または電気軸が変化する心室頻拍は多形性に分類されます。 リズムは不規則であることがある。 多形性心室頻拍は一般的に非常に速く(100~320拍/分)、不安定である。 多形性心室頻拍にはいくつかの種類があります。 最も多い原因は心筋虚血である。 2番目に多い原因はQTc間隔の延長(QT延長症候群)です。
家族性カテコールアミン作動性多形性心室頻拍(CPVT)は遺伝性の心室頻拍で、情動や身体的ストレスによって不整脈を誘発し、循環虚脱や心停止に至ることがあります。 このタイプの心室頻拍は、双方向性(後述)の場合があります。 交感神経の活動により頻拍が誘発されるため、運動負荷試験により診断を確定する。
ブルガダ症候群は多形性VT(多くは睡眠時や発熱時)を引き起こす。
早期再分極や肥大性閉塞性心筋症も多形性VTを引き起こす。
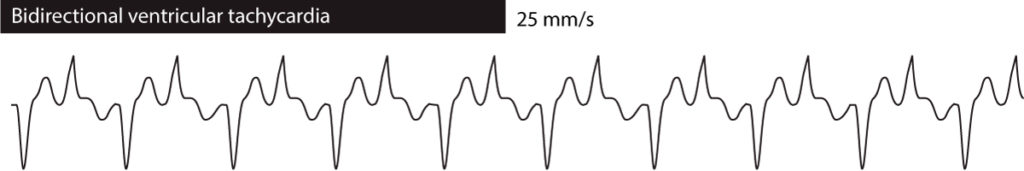
双方向型心室頻拍とはQRS形態があるebatから別のbeatに交代していることを意味する。 多くの場合、QRS複合体の2つの変型の間で交互に発生する。 双方向性心室頻拍は、家族性CPVT、ジゴキシン過剰摂取、QT延長症候群などでみられる。 図3参照
虚血性心疾患における心室頻拍
冠動脈疾患(虚血性心疾患)は心室頻拍の原因として圧倒的に多く、そのメカニズムのほとんどは再入力です。 この章の前半で述べたように、リエントリーは脱分極インパルスの前方に中心ブロックがあり、ブロックの周囲の細胞は伝導率が変化している場合に起こります。 虚血性心疾患では、中心ブロックは典型的には虚血/壊死心筋(インパルスを伝えない)であり、周囲の細胞は虚血による伝導機能不全である。 虚血による心室頻拍は、心室細動や心停止に発展する危険性が高く、
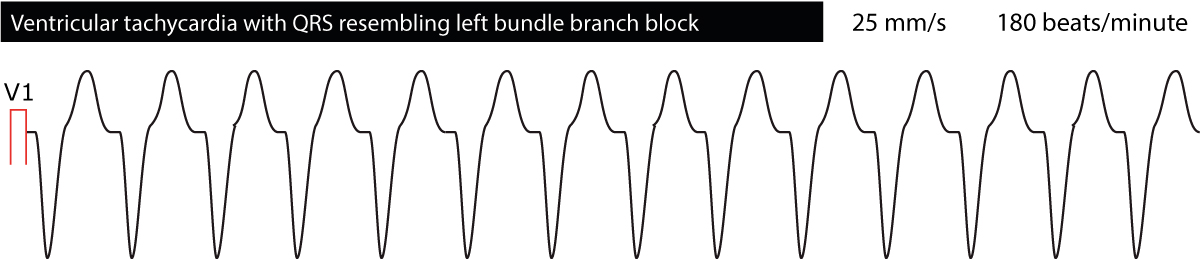
したがって、冠動脈疾患における心室頻拍は、ほとんどが単形性である。 心室頻拍の原因となる異所性病巣が複数ある場合や、1つの病巣からのインパルスがさまざまに広がる場合は、多形性である可能性があります。 これは、心室頻拍を「左脚束枝出現」と「右脚束枝出現」のいずれかに大別することで行われます。 心電図波形が左脚ブロック(V1のS波が優位)を想起させる心室頻拍は、右心室から発生するものである。 その逆、すなわち右脚ブロック(V1ではR波が支配的)を想起させる心室頻拍は左心室から発生する。 このことは、心室頻拍の原因が何であるかを読み解くのに有効であると思われます。 図4と図5にその例を示します。 右脚ブロック(RBBB)形態を有する心室頻拍。 しかし、第1R波が第2R波より大きく、RBBBではありえない。 このことから、このリズムはRBBBで行われる上室性頻拍ではなく、心室性頻拍(VT)であると考えられます。
心室頻拍と広いQRS複合体を持つ上室性頻拍の区別
時々上室性頻拍(ほとんどは正常なQRS複合体、すなわちQRS時間<0.12秒)を示すことがあり、広いQRS複合体を示すことがあります。 これは、束縛ブロックの併発、異常、高カリウム血症、予備興奮、薬剤(三環系抗うつ薬、クラスI抗不整脈薬)の副作用によるものと思われます。 QRSの広い上室性頻拍とVTを鑑別することは基本であり、その理由は簡単である。 VTは生命を脅かす可能性があるが、上室性不整脈はめったにない。 したがって、広いQRSは心室性であることを保証するものではない。
幸い、心室性頻拍と上室性頻拍(SVT)を分けるいくつかの特徴がある。 これらの特徴は個別に、あるいはアルゴリズム(使いやすいもの)を用いて、広いQRS複合をもつ頻拍(しばしば広複合頻拍と呼ばれる)が心室頻拍かSVTかを判断することができる。 これらの特徴とアルゴリズムにこだわる前に、すべての広帯域複合型頻拍の90%が心室性頻拍であることに注目すべきである。
心室頻拍の特徴について説明します。
房室解離
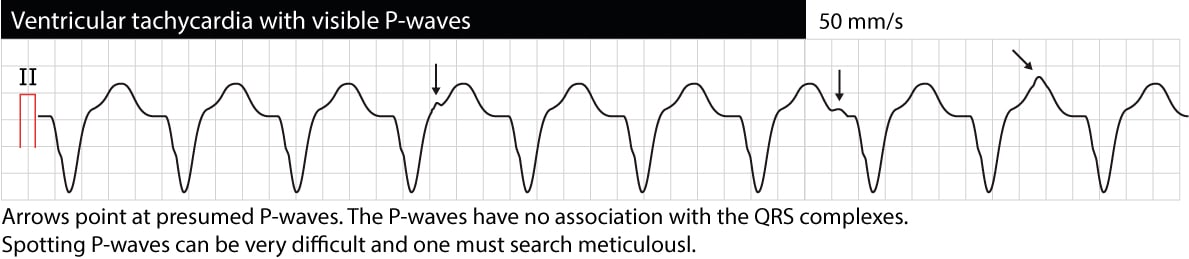
房室解離とは、心房と心室が互いに独立して機能することを意味します。 心電図上では、QRS複合体と関係のないP波として現れます(P-P間隔はR-R間隔とは異なり、PR間隔は変動し、PとQRSは関係ありません)。 VT中のP波の識別は困難な場合が多いので注意する(食道心電図が非常に有効である)。 房室解離が確認できれば、VTが不整脈の原因である可能性は非常に高い。 しかし、時には心室のインパルスが逆行性にHis束と房室結節を通って心房に伝わり、心室と同期して心房を脱分極することがあり、VTは実際には同期したP波を示すことがある。 次の心電図は房室解離を伴うVTです(矢印はP波を指しています)。
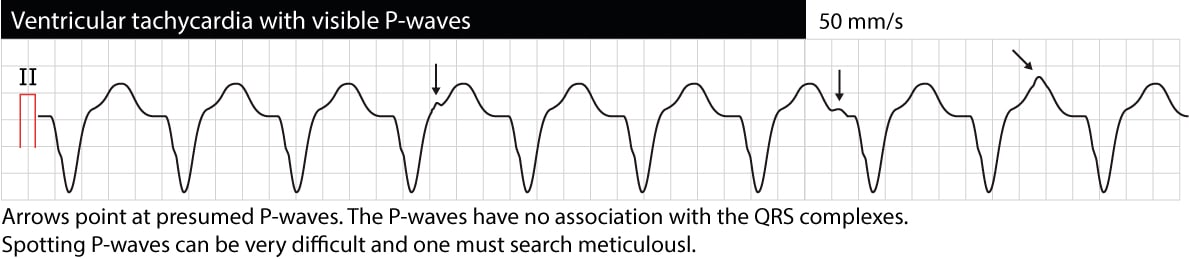
頻脈性不整脈の開始
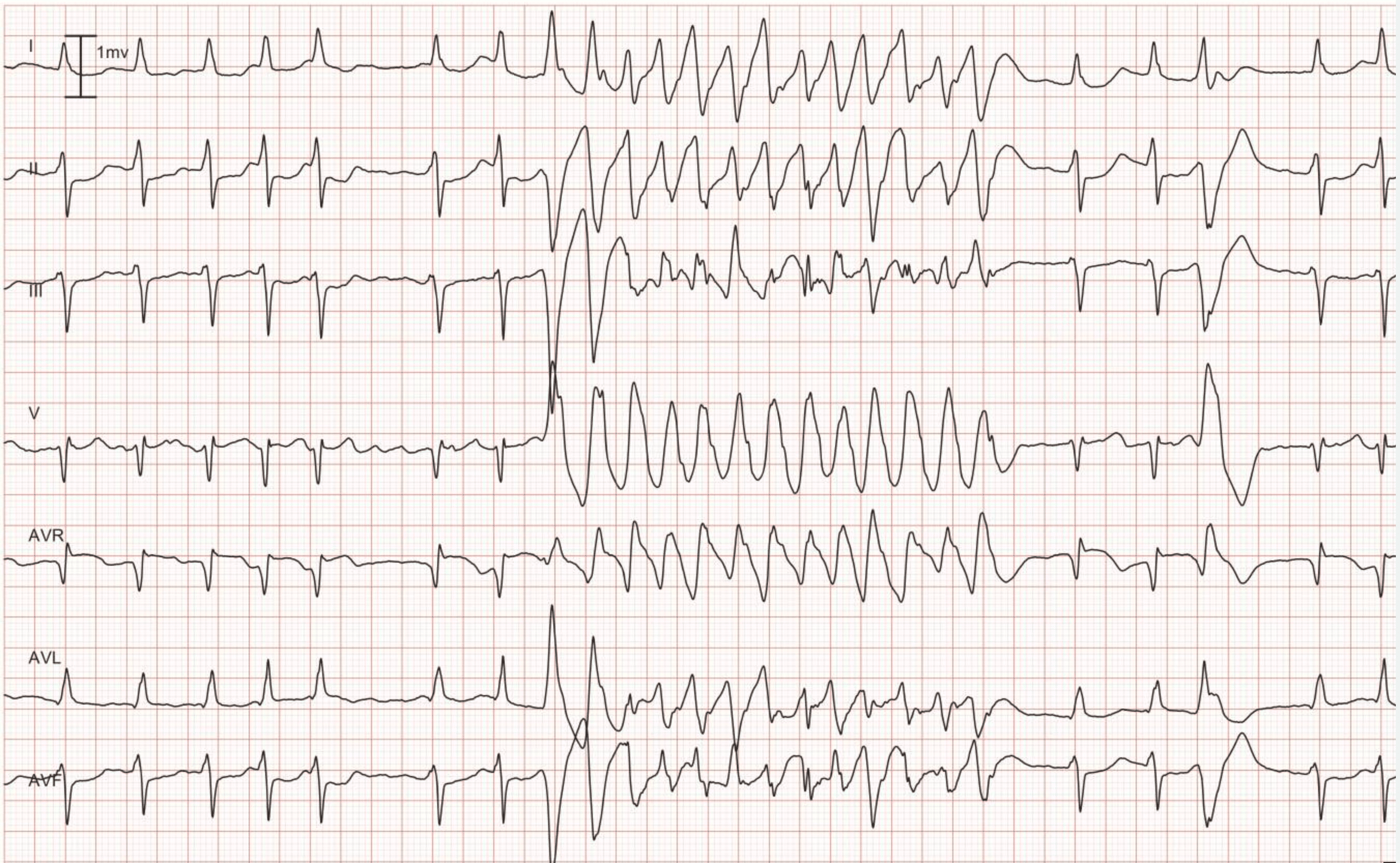
頻脈の開始が記録されていれば、最初の拍動を評価することが重要である。 頻拍開始時のR-R間隔が不規則であれば、心室性頻拍を示唆します。 これはワープアップ現象と呼ばれ、心室性頻拍に特徴的です。 上室性頻拍はウォームアップ現象を示さない(心房性頻拍を除く)
心房性早発による誘発
心室性頻拍は心房性早発による誘発はないが、上室性頻拍は典型的なものである。
融合拍動 & capture beats
心房インパルスがHis-Purkinjeシステムに入ると同時に心室インパルスが放出されると、心室は両方によって脱分極されることになる。 その結果、QRS複合体は正常なQRSと広いQRSの両方に似た外観を持つことになる。 このような拍動は融合拍動と呼ばれ、心室頻拍の診断になる。 図6にその例を示す。
心室頻拍中、時折、心房インパルスが突破し、心室を脱分極させることがある。 これは、頻拍の最中に正常な拍動が発生したものとみなされます。 このような拍動は捕捉拍動と呼ばれ、心室頻拍の診断にもなります。 心室頻拍時に見られる捕捉拍と融合拍。
規則性
心室頻拍は、R-R間隔が多少変化しても、ほとんど規則的です。 R-R間隔の離散的な変動は実際に心室頻拍を示唆する。 しかし、多形性心室頻拍は不規則であることがある。 上室性頻拍も不規則な場合があり、最も多いのは心房細動である。 心房細動時の予備興奮は不規則な広帯域複合頻拍を引き起こし、心拍数はほとんどの場合>190拍/分であることに注意する。
束枝ブロックの既往
伝導障害(右または左束枝ブロック)またはQRS複合の他の原因(前駆興奮、薬剤、高カリウム血症)の既往のある人は、頻脈性不整脈時の心電図を洞調律時の心電図(または以前の心電図)と比較する必要があります。 頻脈性不整脈のQRS形態が洞調律時のQRS複合体と類似している場合、SVTである可能性が高い。 さらに、最近、早発性心室複合を起こしたことがあり、頻脈時のQRSが早発性心室複合のQRSと類似していれば、心室頻拍の可能性が高い。
電気軸
電気軸が-90°から-180°の間は心室頻拍を強く疑う(反道 路性AVRTは鑑別診断となるが)。 また、頻拍時の電気軸が洞調律時の電気軸と8277>40°異なる場合も心室頻拍を示唆する。 頻脈性不整脈が右脚ブロックのパターンであるが、電気軸が-30°よりマイナスであれば、心室性頻脈が示唆される。 左脚ブロック型の頻脈であっても電気軸が90°より陽性であれば心室性頻拍を示唆する。 一般に左軸偏位は心室頻拍を示唆する。
QRS duration
QRS duration >0.14 sは心室頻拍を示唆する。 QRS時間>0.16秒は心室性頻拍を強く示唆する。 心室中隔に発生する心室頻拍は、比較的狭いQRS複合(0.120~0.145秒)を持つことがあるので注意が必要である。 クラスI抗不整脈薬、三環系抗うつ薬、高カリウム血症も非常に広いQRS複合体を引き起こすことがある。
V1-V6
Concordanceとは、V1リードからV6リードまでのすべてのQRS複合体が同じ方向に向かい、すべて正または負であることを指す。 もし、いずれかのリードが二相性のQRS複合体(例:qR複合体またはRS複合体)を示す場合は、concordanceではありえない。 ネガティブコンコーダンス(すべてのQRS複合がネガティブ)は心室頻拍を強く示唆する)。 正の一致(すべてのQRS複合体が正)は、ほとんどが心室性頻拍によるものであるが、反道 路性AVRTによる場合もある。 下図にコンコーダンスを示す。 結論として、コンコーダンスは心室性頻拍を強く示唆する。 心室頻拍におけるV1からV6までのQRS複合の一致
RS複合の欠如
リードV1からリードV6までのQRS複合(すなわちR波とS波からなる)がない場合、心室頻拍の可能性が非常に高いと考えられます。
アデノシン
心室頻拍が疑われる場合、アデノシンを投与することは推奨されません。 それでもアデノシンを投与することがある(実際には広QRS複合体を有するSVTが疑われる場合)。 アデノシンの効果がない場合や頻拍が加速される場合は、心室性頻拍である可能性が高くなります。 これらのアルゴリズムの概要を以下に示す(詳細は頻脈性不整脈の管理と診断を参照)
Brugada’s algorithm
これは最も使用されるアルゴリズムである。 以下の5つの基準のいずれかを満たせば、心室頻拍と診断できます。
Brugada’s algorithm
- 胸部リード(V1-V6)のいずれかにRS複合がなければ、心室頻拍と診断できます。 そうでなければ、次の基準に進みます。
- RS間隔(R波の開始からS波の直下までの間隔)を評価する。 いずれかのRS間隔が>100msで、R波がS波より広ければ、心室頻拍と診断することができる。 それ以外の場合は、次の基準に進みます。
- 房室解離がある場合は、心室頻拍の診断が可能です。 それ以外の場合は、次の基準に進みます。
- V1、V2、V5、V6のQRS形態を評価します(下記参照)。 QRS形態が心室頻拍に適合する場合、診断は心室頻拍とする。
- 基準を満たさない場合、上室性頻拍と診断することが可能である。
QRSの形態(Brugadaのアルゴリズムの基準4)
V1-V2のQRS複合が右脚ブロックに似ている場合(つまり正QRS)
- V1:
- 単相R複合は心室頻拍を示唆します。
- qR complexは心室頻拍を示唆する。
- RがR’より高ければ心室頻拍を示唆する。
- 三相性複合(rSr’, rsr’, rSR’, rsR’) SVT
V6:
- rS、QS、RあるいはRs complexはVTを示唆する。
V1-V2のQRS複合が左脚ブロックに似ている場合(つまり陰性QRS)
- V1:
- 心室頻拍ではQRS複合の最初の部分は滑らかです。 SVTはQRS複合の開始が鋭い。
- R波の持続時間≧40msは心室頻拍を示唆する。
- QRS複合の開始からS波直下までの持続時間≧60msは心室頻拍を示唆する。
- V6:
- QRあるいはQS複合は心室頻拍を示唆する。
- RあるいはRR複合で初期q波がない場合はSVTを示唆する。
総じて、Brugadaの基準は、心室頻拍の診断に非常に高い感度(90%)と特異度(60-90%)を有しています。
Brugadaのアルゴリズムによる心室頻拍と反道 路性AVRTの鑑別
上記のアルゴリズムでは心室頻拍と反道路性AVRTを区別できない場合がよくあります。 逆行性AVRTは心室頻拍のまれな原因であるが、これらの疾患を鑑別できることは重要である。 患者の年齢が高いほど、また心臓の病気が重いほど、心室頻拍は起こりやすくなります。 Brugadaグループは、逆流性AVRTと心室頻拍を鑑別するためのアルゴリズムも開発しています。 8425>
Brugada’s algorithm for differentiating ventricular tachycardia and antidromic AVRT
- QRS complex is net negative in V4-V6, if ventricular tachycardia is more likely.このアルゴリズムは、心室性頻拍と反主流性AVRTの鑑別のためのアルゴリズムです。
- V4-V6でQRS複合が正味陽性で、V2-V6のいずれかのリードがqR複合を示す場合、心室頻拍の可能性が非常に高い。
- AV解離がある場合、心室頻拍の可能性が非常に高い。
- 心室頻拍の徴候がない場合は、antidromic AVRTを強く考慮すべきです。
心室頻拍の管理
救急時の治療
意識のない患者:心肺蘇生を開始します。
血行動態の不安定な患者(低血圧、狭心症、心不全、ショック、前シンコペ/シンコペ):直ちに電気的除細動で治療する(麻酔時)。 心室頻拍は20-50Jの二相性ショックですでに停止させることができる。 β遮断薬は、徐脈による心室頻拍がない限り、静脈内投与される。 その場合、除細動後にアミオダロン(アミオダロン50mg/ml、6ml、グルコース50mg/ml 14ml、2分間静脈内投与)を投与することが望ましいとされている。 低カリウム血症と低マグネシウム血症は、速やかに是正する必要がある。 心不全、虚血、低血圧、低カリウム血症など、心室頻拍の根底にある原因はすべて迅速に治療することができる。
血行動態が安定した患者には薬物療法(アミオダロン、リドカイン、ソタロール、プロカインアミド)が行われることがある。 これらの薬剤は1種類のみ投与され、ローディングドーズに続いて点滴が行われる。 アミオダロンが第一選択薬で、ローディング用量として150mgを10分間にi.v.ボーラス投与する。 6時間後に1mg/min、18時間後に0.5mg/minで点滴を開始する。 ローディング用量は15分間隔で繰り返すことができる。 アミオダロンの最大投与量は2.2g/日である。 アミオダロンが効かない場合は、薬物療法を検討する前に電気的除細動を検討すべきである。 リドカインは0.75mg/kgを静脈内ボーラス投与し、5-10分後に繰り返すことができる。 同時にリドカイン1-4mg/min(最大量3mg/kg/h)の輸液を開始する。
ジゴキシンによる心室頻拍は、上記の血行動態が安定した患者と同様に治療することができる。 ジゴキシンに対する抗体があることに注意する。
経皮または経静脈ペーシングを行う。
多形性心室頻拍:心室頻拍より高い周波数でのペーシングは心室頻拍を停止させることがあります(ただし、心室細動に移行する危険があります)
捕捉拍が頻発する間欠性心室頻拍は薬理療法が必要です
多発性の心室頻度は不安定と考え直ちに電気的除細動で治療します
心室頻拍が頻発する場合は、心室細動に移行する危険があります。 心電図でQT間隔が長くなければ、β遮断薬を投与することができる。 心電図でQT間隔が長い場合は、トルサード・ド・ポアンツに分類され、治療法についてはこの記事を参照する。 QT間隔延長を認めない場合はアミオダロンを投与することもある。
徐脈による心室頻拍(洞性徐脈、房室ブロックなど)。 徐脈は早発性心室複合体や心室性不整脈を誘発することがある。 これらはアトロピン、イソプロテレノール(イソプレナリン)、経静脈ペーシングで治療する。
心室頻拍の長期治療
左室機能が保たれ無症状の非持続性心室頻拍はβ遮断薬で十分な治療が可能であると考えられる。 ソタロール(QT延長を引き起こす可能性がある)およびアミオダロンも考慮されることがある。 ベラパミルは禁忌です。 心筋梗塞のリスクが高い患者(左室機能の低下、心筋梗塞の既往、構造的心疾患)には、効果的に保護するICDを検討する必要がある。 それ以外では、アミオダロンが心室頻拍の新たなエピソードの予防に最も効果的な薬剤であると思われる。
次の章
QT延長症候群(LQTS)&Torsade de Pointes(TdP)
関連項目
不整脈のメカニズム
管理および 頻拍の診断(狭複合性頻拍、広複合性頻拍)
早発性心室拍動(早発性心室収縮/複合)
心室リズム, 加速度心室リズム(Idioventricular Rhythm)
Pacemaker Mediated Tachycardia (PMT)
Ventricular Fibrillation (VF), 無脈性電気活動(PEA)&突然の心停止(SCA)
冠動脈疾患入門
STEMI – ST上昇型心筋梗塞
NSTEMI – 非ST上昇型心筋梗塞&不安定狭心症
心臓不整脈の全チャプターを見る。




