6.17: Jony wieloatomowe
Nasza dyskusja na temat związków jonowych była ograniczona do jonów jednoatomowych. Jednak bardziej złożone jony, zawierające kilka atomów kowalencyjnie związanych ze sobą, ale o dodatnim lub ujemnym ładunku, występują dość często w chemii. Ładunek ten powstaje, ponieważ całkowita liczba elektronów walencyjnych atomów nie jest w stanie wytworzyć stabilnej struktury. Po dodaniu lub usunięciu jednego lub więcej elektronów, powstaje stabilna struktura. Dobrze znane przykłady takich jonów wieloatomowych to jon siarczanowy (SO42-),
jon wodorotlenkowy (OH-),
jon hydroniowy (H3O+),
i jon amonowy (NH4+).
Atomy w tych jonach są połączone kowalencyjnymi wiązaniami par elektronowych i możemy rysować struktury Lewisa dla jonów tak samo jak dla cząsteczek. Jedyna różnica polega na tym, że liczba elektronów w jonie nie równoważy dokładnie sumy ładunków jądrowych. Albo jest za dużo elektronów, w tym przypadku mamy anion, albo za mało, w tym przypadku mamy kation.
Rozważmy na przykład jon wodorotlenkowy (OH-), dla którego struktura Lewisa to
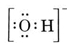
Jednostka neutralna zawierająca jeden atom O i jeden atom H zawierałaby tylko siedem elektronów, sześć z O i jeden z H. Jon wodorotlenkowy zawiera jednak oktet elektronów, o jeden więcej niż cząsteczka neutralna. Jon wodorotlenkowy musi więc posiadać pojedynczy ładunek ujemny. Aby narysować strukturę Lewisa dla danego jonu, musimy najpierw określić, ile elektronów walencyjnych jest zaangażowanych. Załóżmy, że potrzebna jest struktura H3O+. Całkowita liczba elektronów jest otrzymywana przez dodanie elektronów walencyjnych dla każdego atomu, 6 + 1 + 1 + 1 = 9 elektronów. Musimy teraz odjąć 1 elektron, ponieważ rozważany gatunek nie jest H3O, ale H3O+. Całkowita liczba elektronów wynosi więc 9 – 1 = 8. Ponieważ jest to oktet elektronów, możemy je umieścić wokół atomu O. Ostateczna struktura wynika z tego bardzo łatwo:
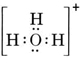
W bardziej skomplikowanych przypadkach często przydatne jest obliczenie liczby wspólnych par elektronowych przed narysowaniem struktury Lewisa. Jest to szczególnie prawdziwe, gdy dany jon jest oksyanionem (tzn. centralny atom jest otoczony przez kilka atomów O). Dobrze znanym oksyanionem jest jon węglanowy, który ma wzór CO32-. (Zauważ, że atom centralny C jest zapisany jako pierwszy, tak jak to miało miejsce wcześniej w przypadku cząsteczek). Całkowita liczba elektronów walencyjnych dostępnych w CO32- wynosi
( 4 ^tekst{(dla C)} + 3 ^times 6 ^text{(dla O)} + 2 erteksty{(dla ładunku -2)} = 24 erteksty)
Musimy rozdzielić te elektrony na 4 atomy, dając każdemu z nich oktet, co daje zapotrzebowanie na 4 × 8 = 32 elektrony. Oznacza to, że 32 – 24 = 8 elektronów musi być liczone dwukrotnie dla celów oktetu; tj. 8 elektronów jest współdzielonych. Jon a zawiera zatem cztery wiązania pary elektronowej. Przypuszczalnie atom C jest podwójnie związany z jednym z O i pojedynczo z dwoma pozostałymi:
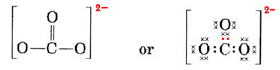
W tym diagramie 4 elektrony C zostały przedstawione za pomocą kropek, 18 elektronów O za pomocą ×, a 2 dodatkowe elektrony za pomocą kolorowych kropek, dla celów łatwego odniesienia. Prawdziwe elektrony nie noszą etykiet w ten sposób; wszystkie są takie same.
Istnieje poważne zastrzeżenie do struktury Lewisa właśnie narysowanej. Skąd elektrony wiedzą, który atom tlenu wyróżnić i utworzyć wiązanie podwójne z, ponieważ w przeciwnym razie nie ma nic do odróżnienia oksygenów? Odpowiedź brzmi, że nie. Wyjaśnienie wiązania w jonie CO32- i niektórych innych cząsteczkach wymaga rozszerzenia teorii Lewisa. Zagadnieniem tym zajmiemy się szerzej przy okazji omawiania rezonansu. Teraz zakończymy przykładem.
Przykład : Struktura Lewisa
Narysuj strukturę Lewisa dla jonu siarczynowego, SO32-.
Rozwiązanie Najbezpieczniejszą metodą jest tu liczenie elektronów. Całkowita liczba dostępnych elektronów walencyjnych wynosi
6(dla S) + 3 × 6(dla O) + 2(dla ładunku) = 26. Aby utworzyć cztery oktety dla czterech atomów potrzeba 32 elektronów, a więc różnica, 32 – 26 = 6, daje liczbę współdzielonych elektronów. W jonie są więc tylko trzy wiązania par elektronowych. Centralny atom S musi być połączony pojedynczym wiązaniem z każdym atomem O.
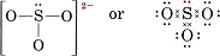
Zauważ, że każde z wiązań S-O jest kowalencyjne współrzędnie.
Współautorzy
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
.




