6.17: Íons Poliatômicos
Nossa discussão sobre compostos iônicos foi confinada aos íons monatômicos. Entretanto, íons mais complexos, contendo vários átomos covalentemente ligados uns aos outros, mas tendo uma carga positiva ou negativa, ocorrem com bastante freqüência na química. A carga surge porque o número total de elétrons de valência dos átomos não pode produzir uma estrutura estável. Com um ou mais elétrons adicionados ou removidos, resulta uma estrutura estável. Exemplos bem conhecidos de tais íons poliatômicos são o íon sulfato (SO42-),
o íon hidróxido (OH-),
o íon hidrogênio (H3O+),
e o íon amônio (NH4+).
Os átomos destes iões são unidos por ligações covalentes de pares de electrões, e podemos desenhar estruturas de Lewis para os iões tal como podemos para as moléculas. A única diferença é que o número de elétrons no íon não equilibra exatamente a soma das cargas nucleares. Ou há demasiados electrões, caso em que temos um ânion, ou muito poucos, caso em que temos um catião.
Considerar, por exemplo, o ião hidróxido (OH-) para o qual a estrutura de Lewis é
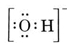 >
>
Uma molécula neutra contendo um átomo O e um H conteria apenas sete electrões, seis de O e um de H. O ião hidróxido, no entanto, contém um octeto de electrões, um a mais do que a molécula neutra. O íon hidróxido deve, portanto, transportar uma única carga negativa. Para desenhar a estrutura de Lewis para um determinado íon, devemos primeiro determinar quantos elétrons de valência estão envolvidos. Suponhamos que a estrutura de H3O+ é necessária. O número total de electrões é obtido adicionando os electrões de valência para cada átomo, 6 + 1 + 1 + 1 = 9 electrões. Devemos agora subtrair 1 elétron já que a espécie em consideração não é H3O, mas H3O+. O número total de elétrons é assim 9 – 1 = 8. Como este é um octeto de elétrons, podemos colocá-los ao redor do átomo O. A estrutura final segue então muito facilmente:
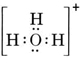
Em casos mais complicados é muitas vezes útil calcular o número de pares de electrões partilhados antes de desenhar uma estrutura Lewis. Isto é particularmente verdadeiro quando o íon em questão é um oxianião (ou seja, um átomo central está rodeado por vários átomos O). Um oxianião bem conhecido é o ião carbonato, que tem a fórmula CO32-. (Note-se que o átomo central C é escrito primeiro, como foi feito anteriormente para as moléculas). O número total de electrões de valência disponíveis no CO32- é
\( 4 \text{(para C)} + 3 vezes 6 texto (para O){(para O)} + 2 \texto{(para a carga -2)} = 24 \)
Devemos distribuir estes electrões por 4 átomos, dando a cada um deles um octeto, um requisito de 4 × 8 = 32 electrões. Isto significa que 32 – 24 = 8 elétrons precisam ser contados duas vezes para o octeto, ou seja, 8 elétrons são compartilhados. O ião contém assim quatro ligações de pares de elétrons. Presumivelmente o átomo C está duplamente ligado a um dos O’s e individualmente ligado aos outros dois:
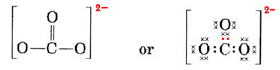
Neste diagrama os 4C elétrons foram representados por pontos, os 18 O elétrons por ×’s, e os 2 elétrons extras por pontos coloridos, para fins de fácil referência. Os electrões reais não carregam etiquetas como esta; são todos iguais.
Há uma objecção séria à estrutura de Lewis que acabou de ser desenhada. Como é que os electrões sabem qual o átomo de oxigénio a destacar e com o qual formar uma dupla ligação, já que de outra forma não há nada que diferencie os oxigenadores? A resposta é que eles não sabem. Para explicar a ligação no íon CO32 e em algumas outras moléculas, é necessária uma extensão da teoria de Lewis. Nós continuamos com este assunto quando discutimos a ressonância. Agora terminamos com um exemplo.
Exemplo \(\PageIndex{1}}) : Estrutura de Lewis
Desenhar uma estrutura de Lewis para o ião sulfito, SO32-.
Solução O método mais seguro aqui é contar elétrons. O número total de elétrons de valência disponíveis é
6(para S) + 3 × 6(para O) + 2(para a carga) = 26 Para fazer quatro octetos para os quatro átomos seriam necessários 32 elétrons, e assim a diferença, 32 – 26 = 6, dá o número de elétrons compartilhados. Assim, existem apenas três ligações de pares de elétrons no íon. O átomo S central deve estar ligado por uma única ligação a cada átomo O.
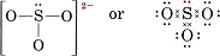
Nota que cada uma das ligações S-O é coordenada covalente.
Contribuintes
-
Ed Vitz (Universidade de Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, e Adam Hahn.




