6.17: Iones poliatómicos
Nuestra discusión de los compuestos iónicos se limitó a los iones monatómicos. Sin embargo, los iones más complejos, que contienen varios átomos unidos covalentemente entre sí, pero que tienen una carga positiva o negativa, ocurren con bastante frecuencia en la química. La carga surge porque el número total de electrones de valencia de los átomos no puede producir una estructura estable. Si se añaden o eliminan uno o más electrones, se obtiene una estructura estable. Ejemplos conocidos de estos iones poliatómicos son el ion sulfato (SO42-),
el ion hidróxido (OH-),
el ion hidronio (H3O+),
y el ion amonio (NH4+).
Los átomos de estos iones están unidos por enlaces covalentes de pares de electrones, y podemos dibujar estructuras de Lewis para los iones igual que para las moléculas. La única diferencia es que el número de electrones en el ion no equilibra exactamente la suma de las cargas nucleares. O hay demasiados electrones, en cuyo caso tenemos un anión, o muy pocos, en cuyo caso tenemos un catión.
Consideremos, por ejemplo, el ion hidróxido (OH-) cuya estructura de Lewis es
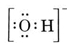
Una molécula neutra que contiene un átomo de O y otro de H contendría sólo siete electrones, seis del O y uno del H. El ion hidróxido, sin embargo, contiene un octeto de electrones, uno más que la molécula neutra. Por tanto, el ion hidróxido debe tener una sola carga negativa. Para dibujar la estructura de Lewis de un ion dado, primero debemos determinar cuántos electrones de valencia están involucrados. Supongamos que se necesita la estructura del H3O+. El número total de electrones se obtiene sumando los electrones de valencia de cada átomo, 6 + 1 + 1 + 1 = 9 electrones. Ahora debemos restar 1 electrón ya que la especie considerada no es H3O sino H3O+. El número total de electrones es, pues, 9 – 1 = 8. Como se trata de un octeto de electrones, podemos colocarlos todos alrededor del átomo de O. La estructura final se obtiene muy fácilmente:
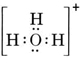
En casos más complicados suele ser útil calcular el número de pares de electrones compartidos antes de dibujar una estructura de Lewis. Esto es particularmente cierto cuando el ion en cuestión es un oxianión (es decir, un átomo central está rodeado por varios átomos de O). Un oxianión bien conocido es el ion carbonato, que tiene la fórmula CO32-. (Obsérvese que el átomo central C se escribe primero, como se hizo antes para las moléculas). El número total de electrones de valencia disponibles en CO32- es
( 4 \text{(para C)} + 3 veces 6 |texto(para el O)} + 2 \text{(para la carga -2)} = 24 \t)
Debemos distribuir estos electrones en 4 átomos, dando a cada uno un octeto, una necesidad de 4 × 8 = 32 electrones. Esto significa que 32 – 24 = 8 electrones deben contarse dos veces a efectos del octeto; es decir, se comparten 8 electrones. Por tanto, el ion a contiene cuatro enlaces de pares de electrones. Es de suponer que el átomo de C tiene un doble enlace con uno de los O y un enlace simple con los otros dos:
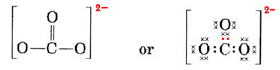
En este diagrama los 4 electrones de C se han representado con puntos, los 18 electrones de O con ×, y los 2 electrones extra con puntos de color, para facilitar la referencia. Los electrones reales no llevan etiquetas como ésta; son todos iguales.
Hay una seria objeción a la estructura de Lewis que se acaba de dibujar. ¿Cómo saben los electrones qué átomo de oxígeno deben separar y formar un doble enlace, ya que no hay nada que diferencie a los oxígenos? La respuesta es que no lo saben. Para explicar el enlace en el ion CO32- y en algunas otras moléculas se requiere una extensión de la teoría de Lewis. Seguimos con este asunto cuando hablamos de la resonancia. Ahora terminamos con un ejemplo.
Ejemplo \(\PageIndex{1}) : Estructura de Lewis
Dibuja una estructura de Lewis para el ion sulfito, SO32-.
Solución El método más seguro aquí es contar los electrones. El número total de electrones de valencia disponibles es
6(para el S) + 3 × 6(para el O) + 2(para la carga) = 26Para hacer cuatro octetos para los cuatro átomos se necesitarían 32 electrones, y así la diferencia, 32 – 26 = 6, da el número de electrones compartidos. Por tanto, sólo hay tres enlaces de pares de electrones en el ion. El átomo central de S debe estar unido por un solo enlace a cada átomo de O.
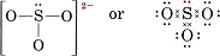
Nótese que cada uno de los enlaces S-O es covalente de coordenadas.
Contribuidores
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff y Adam Hahn.




