Tumeurs bénignes de la vulve | GLOWM
Condylome acuminé
Les infections de la vulve par le papillomavirus humain (HPV) sont des événements cliniques courants. Les infections à HPV sont classées comme cliniques ou subcliniques, en fonction de l’infectivité du virus et de la réponse de l’épithélium affecté. L’expression typique est une lésion épithéliale papillaire molle, rose-blanche. Ces lésions peuvent se présenter isolément ou en groupes qui peuvent devenir confluents (Fig. 1). Les localisations vulvaires habituelles sont le prépuce, le vestibule et le corps périnéal. Les loci périanaux et anaux sont également fréquemment observés.
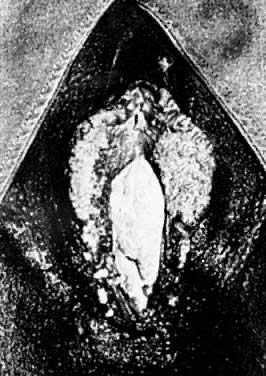 Fig. 1. Condylomes acuminés vulvaires multiples.
Fig. 1. Condylomes acuminés vulvaires multiples.
Bien qu’il existe plus de 60 sous-types de VPH, relativement peu affectent la vulve.1 Les sous-types de VPH les plus fréquemment rencontrés sur la vulve sont le VPH 6 et le VPH 11. Le VPH 2, le virus associé aux verrues épithéliales communes, est également présent dans l’épithélium pavimenteux de la vulve.2 Les sous-types de VPH qui sont associés à une incidence plus élevée de transformation maligne sur le col de l’utérus, notamment les VPH 16, 18, 31 et 35, peuvent être présents dans les lésions vulvaires.1 L’incidence du diagnostic des lésions vulvaires, vaginales et cervicales dues au VPH a augmenté de manière significative au cours des trois dernières décennies.3 Cette augmentation est en partie attribuable aux progrès des techniques de diagnostic, telles que la réaction en chaîne par polymérase et les techniques d’hybridation de l’ADN. Bien qu’il soit difficile d’estimer l’incidence ou la prévalence de l’infection, les pourcentages estimés de patients présentant une infection à HPV clinique et subclinique dans certaines populations collégiales dépassent 40 %.1 Il n’existe pas de méthode fiable pour identifier une infection subclinique ou dormante. Même si l’on ne prend en compte que le HPV cliniquement exprimé, il s’agit aujourd’hui de l’une des maladies sexuellement transmissibles les plus courantes. Certaines infections à HPV peuvent évoluer vers une néoplasie intraépithéliale vulvaire (VIN) et un segment encore plus petit peut évoluer vers un carcinome épidermoïde franchement invasif de la vulve, mais la majorité des lésions se limitent à l’expression cutanée du HPV connue sous le nom de verrue vénérienne ou condylome. Les états immunodéprimés et la grossesse sont associés à l’élargissement et à la progression des lésions condylomateuses (Fig. 2).3
 Fig. 2. Condylomes acuminés hypertrophiques chez une patiente enceinte.
Fig. 2. Condylomes acuminés hypertrophiques chez une patiente enceinte.
Histologiquement, les condylomes apparaissent comme des papillomes épithéliaux avec acanthose et parakératose (Fig. 3). Certaines cellules épithéliales présentent des noyaux atypiques et des halos périnucléaires qui seraient une manifestation de l’infection par le HPV.2 Ces cellules sont appelées koïlocytes. Le stroma sous-jacent présente généralement une légère réaction inflammatoire. Les biopsies des lésions condylomateuses qui résistent au traitement ou qui ont un aspect anormal doivent être réalisées pour confirmer le diagnostic par histologie. La différenciation entre les condylomes et la papillomatose vulvaire ou d’autres lésions vulvaires peut alors être faite.
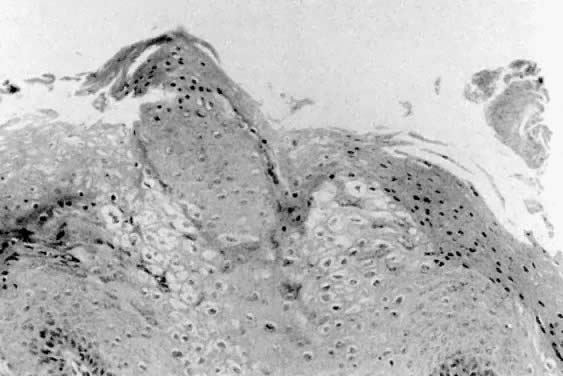 Fig. 3. Condylomes présentant une acanthose, une parakératose et des modifications koïlocytaires.
Fig. 3. Condylomes présentant une acanthose, une parakératose et des modifications koïlocytaires.
Le traitement consiste en la destruction des manifestations cutanées de l’infection à HPV. L’éradication du virus de l’épithélium n’est pas possible cliniquement. Le contrôle de l’expression virale épithéliale peut être réalisé avec des agents topiques tels que l’acide trichloracétique, l’acide bichloracétique, la podophylline ou ses dérivés, ou le 5-fluorouracile (5-FU) topique. La cryothérapie, la vaporisation au laser et l’électroexcision ou la dessiccation sont d’autres méthodes de traitement. L’administration intralésionnelle ou systémique d’interféron est une autre option thérapeutique qui est généralement réservée aux lésions récalcitrantes. Les expressions cutanées virales récurrentes sont généralement prises en charge par des traitements alternatifs ou des combinaisons de traitements.
Le carcinome verruqueux de la vulve apparaît comme un grand condylome ou une lésion suspecte de carcinome invasif. La lésion, décrite pour la première fois par Buschke et Lowenstein comme un condylome géant,2 est associée au sous-type viral HPV 6.1 Le carcinome verruqueux peut toucher de grandes surfaces de la vulve, et il présente une bordure poussante plutôt qu’infiltrante. De manière caractéristique, il est localisé à la vulve. La gestion est mieux accomplie par une excision large et une évaluation postopératoire attentive.
Néoplasie intraépithéliale vulvaire
La néoplasie intraépithéliale vulvaire est une lésion malpighienne hyperplasique avec des atypies qui est confinée à l’épithélium. La VIN est histologiquement divisée en trois catégories : VIN I (dysplasie légère), VIN II (dysplasie modérée) et VIN III (dysplasie sévère et carcinome in situ). Les lésions de VIN sont suffisamment atypiques pour être considérées comme prémalignes. L’incidence de la progression vers un processus invasif malin est relativement faible (10 à 15 %), et le délai de progression peut s’étendre sur plusieurs années.4
La maladie de Bowen, la VIN III et le carcinome in situ sont des termes cliniquement synonymes. Ces lésions se présentent comme des épaississements épithéliaux hyperkératosiques, surélevés et souvent pigmentés (figure 4). Elles surviennent généralement chez les femmes de la sixième décennie ou plus ; cependant, un âge plus jeune n’exclut pas le diagnostic. Les résultats de la biopsie montrent des atypies épithéliales sur toute l’épaisseur de la peau et une activité mitotique (Fig. 5). Les zones affectées peuvent être asymptomatiques ou excoriées par le grattage. Toute lésion épaissie, surélevée ou hyperkératosique observée lors d’un examen gynécologique doit faire l’objet d’une biopsie, quels que soient les symptômes associés. Les lésions vulvaires peuvent être multifocales ; par conséquent, il est recommandé de réaliser plusieurs biopsies. Le rehaussement des lésions avec des colorants tels que le bleu de toluidine a été recommandé pour tenir compte de la nature multifocale de ces lésions. Le bleu de toluidine devrait colorer les zones de concentration nucléaire qui sont associées à la VIN III ; cependant, la plupart des lésions sont hyperkératosiques et la surface kératinique empêche la pénétration du colorant dans les noyaux épithéliaux. Une approche plus efficace consiste à appliquer une solution d’acide acétique diluée sur la vulve. Les zones d’expression de la VIN et du HPV deviennent blanc acétique après un trempage de plusieurs minutes.4 La vulve peut alors être examinée à l’aide d’une loupe ou d’un colposcope. De cette manière, les changements épithéliaux subtils sont plus facilement identifiés.
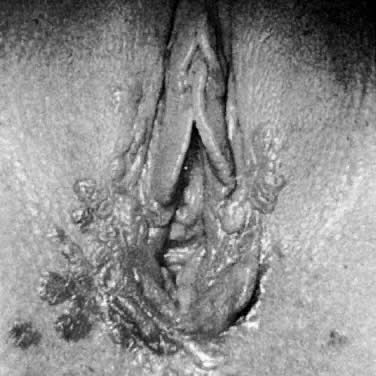 Fig. 4. Carcinome in situ montrant un épaississement épithélial pigmenté hyperkératosique.
Fig. 4. Carcinome in situ montrant un épaississement épithélial pigmenté hyperkératosique.
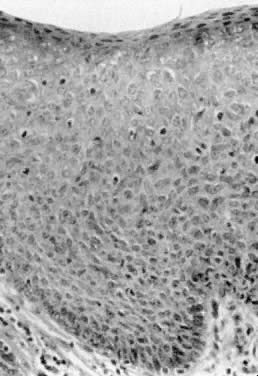 Fig. 5. Carcinome in situ montrant des atypies épithéliales dans toute la couche épithéliale.
Fig. 5. Carcinome in situ montrant des atypies épithéliales dans toute la couche épithéliale.
La maladie de Bowen ou la VIN III doit être traitée par excision chirurgicale, laser ou électrique.4 Il est préférable d’enlever la lésion avec une technique qui fournit des tissus pour une étude histologique plus approfondie. L’utilisation de 5-FU ou d’interféron systémique n’a donné que des résultats marginaux.3,5 L’excision chirurgicale avec évaluation des marges reste l’option de traitement préférée. Un suivi étroit pour évaluer la récurrence est suggéré.
La papillose bowenoïde a une présentation clinique et pathologique qui est similaire à celle de la VIN III. Elle survient chez des patients dans les deuxième, troisième et quatrième décennies de la vie. Elle se manifeste par des lésions papillomateuses multiples qui peuvent toucher plusieurs zones de la vulve.3,4 Ces lésions sont associées à des infections par le VPH. Les résultats de la biopsie montrent des atypies épithéliales avec des modifications koïlocytaires du VPH. L’évolution vers une tumeur maligne invasive se produit dans de rares cas, notamment chez les patients immunodéprimés ou immunocompromis. La prise en charge est conservatrice, sauf en cas de lésions précancéreuses. Les lésions prémalignes sont traitées de manière similaire aux VIN.
Carcinome basocellulaire
Les carcinomes basocellulaires sont généralement asymptomatiques jusqu’à ce qu’ils soient assez gros pour être remarqués par le patient ou jusqu’à ce qu’une ulcération et un saignement se développent. La tumeur est ferme avec des bords roulés, et se trouve le plus souvent sur les grandes lèvres des femmes ménopausées. Les métastases sont rares. Le traitement consiste en une excision large de la tumeur avec des marges adéquates. Une évaluation des métastases doit être envisagée si le spécimen excisé montre une invasion de la graisse sous-cutanée, une épaisseur de la tumeur supérieure à 1 cm ou une implication de l’urètre ou du vagin. Les carcinomes basocellulaires représentent 2 à 4 % des néoplasmes bénins de la vulve.6
Histologiquement, ces tumeurs présentent une palissade périphérique des cellules basales au niveau des marges épithéliales. Le reste de la tumeur est constitué de cellules uniformes et serrées, avec des noyaux basophiles et un cytoplasme peu abondant. Les figures mitotiques sont fréquentes. Ces tumeurs sont localement invasives ; par conséquent, une étude approfondie de la lésion entière est nécessaire. Les marges en particulier doivent être évaluées et rapportées pour leur adéquation. Les marges de moins de 4 mm présentent un risque plus élevé de récidive.
Acrochordon
Les polypes fibroépithéliaux sont fréquents dans l’épithélium vulvaire. Ils sont désignés comme des étiquettes de peau. Il n’y a pas de potentiel malin pour cette lésion. Il s’agit de structures molles, de couleur chair et polypoïdes. Les appendices cutanés et les poils ne sont pas caractéristiques de l’acrochordon. Le traitement est l’excision locale des lésions symptomatiques.
Histologiquement, l’acrochordon est décrit comme un pédoncule fibrovasculaire avec un épithélium pavimenteux hyperkératosique mature. Les appendices épidermiques sont peu fréquents, et le motif vasculaire peut être renforcé.
Hidradénome
Les idradénomes sont des tumeurs des glandes sudoripares apocrines. Certains peuvent avoir une origine dans les glandes sudoripares eccrines. Ils mesurent généralement moins de 1 cm de diamètre et apparaissent sur la face médiale des grandes lèvres (figure 6). Les lésions sont fermes et librement mobiles. Une ulcération et une douleur peuvent apparaître si la lésion entre en contact avec la surface épithéliale. Le traitement consiste en une excision chirurgicale.
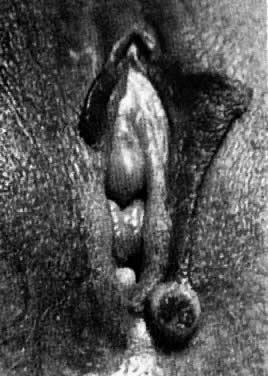 Fig. 6. Hidradénome de la vulve.
Fig. 6. Hidradénome de la vulve.
Histologiquement, l’hidradénome présente des espaces kystiques qui sont tapissés de cellules cylindriques. La lésion est en outre caractérisée par de nombreux plis complexes, des structures papillaires et une prolifération glandulaire prononcée (figure 7). Cette lésion peut être confondue avec un adénocarcinome. Les caractéristiques distinctives de l’hidradénome comprennent l’absence de pléomorphisme, d’empilement de cellules et de conformité nucléaire.
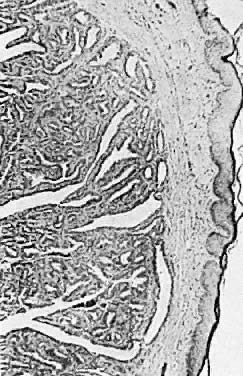 Fig. 7. Hidradénome de la vulve ( × 25)
Fig. 7. Hidradénome de la vulve ( × 25)
Syringome
Les syringomes sont de petits hamartomes bénins des glandes sudoripares eccrines. Habituellement, des lésions multiples sont présentes, et elles peuvent se produire à plus d’un endroit sur le corps. Les lésions sont asymptomatiques et aucun traitement n’est nécessaire à moins qu’une douleur ou un prurit ne se développe.7
Microscopiquement, il s’agit de tumeurs de conduits de glandes sudoripares dilatés, et de kystes tapissés de cellules cuboïdes bénignes (Fig. 8). Une réponse inflammatoire minime est présente à moins que les kystes ne se rompent.
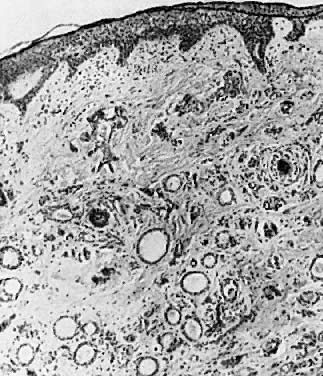 Fig. 8 . Syringome De nombreux conduits dilatés des glandes sudoripares sont visibles ( × 35).
Fig. 8 . Syringome De nombreux conduits dilatés des glandes sudoripares sont visibles ( × 35).
Tumeurs vulvaires pigmentées
Les lésions vulvaires pigmentées se produisent chez 10 à 12 % de toutes les femmes. Deux pour cent présentent des changements pigmentés avec des caractéristiques pré-malignes. Les lésions pigmentées bénignes sont classées en lentigines, mélanose vulvaire et naevus.
Les lentigines sont de petites macules (1 à 4 mm), bien circonscrites. Elles apparaissent chez 3 à 6 % des femmes. Les lentigines font également partie de plusieurs syndromes qui comprennent un myxome auriculaire et d’autres défauts de structure et de conduction cardiaques (syndrome de LAMB, syndrome de LEOPARD).8 Aucun traitement n’est nécessaire.
Histologiquement, les lentigines sont similaires aux naevus jonctionnels. On observe une hyperplasie de l’épiderme et une augmentation de la mélanine dans la couche basale de la peau. Les atypies nucléaires ne sont pas observées dans le tissu hyperplasique.
La mélanose vulvaire est une lésion plus grande que le lentigo et dont la bordure est irrégulière. Histologiquement, un nombre accru de mélanocytes et de mélanophages dermiques sont présents. On observe un dépôt de mélanine dans les couches basales et suprabasales de l’épiderme. La mélanose et les lentigines vulvaires font partie d’un spectre de modifications de la pigmentation de la vulve. Il est important de les distinguer des mélanomes en effectuant une biopsie d’une zone représentative.
Les nævus vulvaires se produisent chez 2% des femmes. Les nævus sont classés en intradermiques, jonctionnels et composés. Le naevus intradermique naît dans le derme (Fig. 9), et le naevus jonctionnel naît de la couche basale de l’épiderme (Fig. 10). Le nævus composé présente les caractéristiques des nævus intradermiques et jonctionnels (figure 11). L’évaluation histologique des mélanocytes à la recherche d’une architecture atypique et de modifications cytologiques permet de distinguer les naevus pigmentés des mélanomes. Les nævus irrités ou qui saignent doivent être excisés. Un indice de suspicion élevé et une utilisation libérale de l’excision doivent faire partie du schéma de gestion.
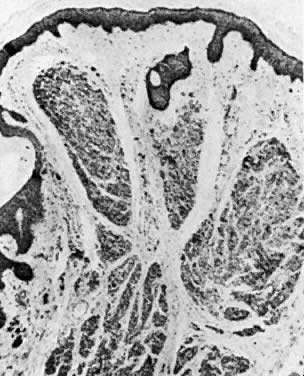 Fig. 9. Naevus intradermique. Les cellules du naevus sont visibles dans le derme supérieur ( × 40)
Fig. 9. Naevus intradermique. Les cellules du naevus sont visibles dans le derme supérieur ( × 40)
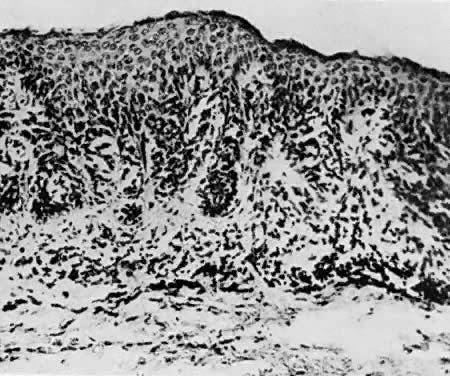 Fig. 10. Naevus jonctionnel. Ce type peut devenir malin ( × 50)
Fig. 10. Naevus jonctionnel. Ce type peut devenir malin ( × 50)
 Fig. 11. Naevus composé. Les cellules du naevus sont visibles à la jonction de l’épiderme et du derme et dans le derme supérieur (× 50)
Fig. 11. Naevus composé. Les cellules du naevus sont visibles à la jonction de l’épiderme et du derme et dans le derme supérieur (× 50)
.




