6.17: Poliatomos ionok
Az ionos vegyületek tárgyalása az egyatomos ionokra korlátozódott. A kémiában azonban igen gyakran fordulnak elő összetettebb, több, kovalensen egymáshoz kötött, de pozitív vagy negatív töltéssel rendelkező atomot tartalmazó ionok. A töltés azért keletkezik, mert az atomok összes valenciaelektronjainak száma nem képes stabil szerkezetet létrehozni. Egy vagy több elektron hozzáadásával vagy eltávolításával stabil szerkezet jön létre. Az ilyen többatomos ionok jól ismert példái a szulfátion (SO42-),
a hidroxidion (OH-),
a hidróniumion (H3O+),
és az ammóniumion (NH4+).
Az ionok atomjai kovalens elektronpár-kötésekkel kapcsolódnak egymáshoz, és az ionokra ugyanúgy rajzolhatunk Lewis-szerkezeteket, mint a molekulákra. Az egyetlen különbség az, hogy az ionban lévő elektronok száma nem pontosan egyenlíti ki a magtöltések összegét. Vagy túl sok elektron van, ebben az esetben anionról van szó, vagy túl kevés, ebben az esetben kationról.
Lássuk például a hidroxidiont (OH-), amelynek Lewis-szerkezete
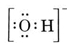
Egy semleges molekula, amely egy O- és egy H-atomot tartalmaz, csak hét elektront tartalmazna, hatot az O-ból és egyet a H-ból. A hidroxidion azonban nyolctagú elektront tartalmaz, eggyel többet, mint a semleges molekula. A hidroxidionnak tehát egyetlen negatív töltést kell hordoznia. Ahhoz, hogy meg tudjuk rajzolni egy adott ion Lewis-szerkezetét, először meg kell határoznunk, hogy hány valenciaelektronról van szó. Tegyük fel, hogy a H3O+ szerkezetére van szükség. Az elektronok teljes számát az egyes atomok valenciaelektronjainak összeadásával kapjuk meg: 6 + 1 + 1 + 1 + 1 = 9 elektron. Most le kell vonnunk 1 elektront, mivel a vizsgált faj nem H3O, hanem H3O+. Az elektronok teljes száma tehát 9 – 1 = 8. Mivel ez egy nyolcas elektronszám, az elektronokat az O atom körül tudjuk elhelyezni. A végső szerkezet így nagyon könnyen következik:
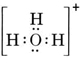
Bonyolultabb esetekben gyakran hasznos a megosztott elektronpárok számát kiszámítani, mielőtt megrajzolnánk a Lewis-szerkezetet. Ez különösen igaz akkor, ha a kérdéses ion egy oxianion (azaz egy központi atomot több O atom vesz körül). Egy jól ismert oxianion a karbonátion, amelynek képlete CO32-. (Figyeljük meg, hogy a központi C atomot írjuk először, ahogyan azt korábban a molekulák esetében tettük). A CO32–ban rendelkezésre álló valenciaelektronok száma összesen
\( 4 \text{(C-re)} + 3 \times 6 \text{(az O számára)} + 2 \text{(a -2 töltésért)} = 24 \)
Ezeket az elektronokat 4 atomra kell elosztanunk, így mindegyiknek egy oktettje lesz, ami 4 × 8 = 32 elektront jelent. Ez azt jelenti, hogy 32 – 24 = 8 elektront kétszer kell megszámolni a nyolcaddöntéshez, azaz 8 elektronon osztozunk. Az a-ion tehát négy elektronpáros kötést tartalmaz. Feltehetően a C atom az egyik O-hez kettős kötéssel, a másik kettőhöz pedig egyszerű kötéssel kapcsolódik:
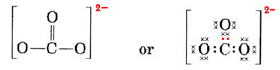
Az ábrán a 4C elektronokat pontokkal, a 18 O elektront ×-ekkel, a 2 plusz elektront pedig színes pontokkal ábrázoltuk a könnyebb áttekinthetőség kedvéért. A valódi elektronok nem viselnek ilyen címkéket; mind egyformák.
Az imént megrajzolt Lewis-szerkezettel szemben van egy komoly ellenvetés. Honnan tudják az elektronok, hogy melyik oxigénatomot válasszák ki, hogy kettős kötést képezzenek vele, hiszen egyébként semmi sem különbözteti meg az oxigéneket? A válasz az, hogy nem tudják. A CO32-ion és néhány más molekula kötésének magyarázatához a Lewis-féle elmélet kiterjesztésére van szükség. Ezt a kérdést tovább folytatjuk, amikor a rezonanciát tárgyaljuk. Most egy példával zárjuk.
Példa \(\PageIndex{1}\) : Lewis szerkezet
Rajzoljuk meg a szulfition, SO32- Lewis szerkezetét.
Megoldás A legbiztosabb módszer itt az elektronok számolása. A rendelkezésre álló valenciaelektronok száma összesen
6(az S számára) + 3 × 6(az O számára) + 2(a töltés számára) = 26A négy atom négy oktettjének kialakításához 32 elektronra lenne szükség, így a különbség, 32 – 26 = 6 adja a megosztott elektronok számát. Az ionban tehát csak három elektronpáros kötés van. A központi S atomnak minden O atomhoz egyetlen kötéssel kell kapcsolódnia.
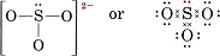
Megjegyezzük, hogy az S-O kötések mindegyike koordinátakovalens.
Megbízottak
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff és Adam Hahn.




