6.17: 多原子イオン
イオン化合物の議論は、単原子イオンに限定して行われました。 しかし、より複雑なイオンは、いくつかの原子が互いに共有結合しているが、正または負の電荷を持つもので、化学ではかなり頻繁に出現します。 電荷は、原子の価電子の総数では安定な構造を作れないために生じる。 1つ以上の電子を追加または削除することで、安定した構造が得られる。 よく知られている例としては、硫酸イオン(SO42-)、
水酸化物イオン(OH-)、
ヒドロニウムイオン(H3O+)、
そしてアンモニウムイオン(NH4+)がある。
これらのイオンの原子は共有電子対結合で結ばれており、分子と同じようにイオンのルイス構造も描くことができます。 唯一の違いは、イオン内の電子の数が核電荷の合計と正確に釣り合っていないことです。 例えば、水酸化物イオン(OH-)のルイス構造は
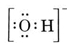
となる。
OとH原子を1つずつ持つ中性分子は、Oから6個、Hから1個の合計7個の電子しか持っていないが、水酸化物イオンには中性分子よりも1個多い8個の電子がある。 したがって、水酸化物イオンは1つの負電荷を持たなければならない。 あるイオンのルイス構造を描くには、まず価電子がいくつあるかを決定しなければなりません。 例えば、H3O+の構造が必要だとします。 各原子の価電子を足すと、6 + 1 + 1 + 1 = 9個の電子が得られます。 ここで、対象となる化学種はH3OではなくH3O+なので、1電子差し引かなければならない。 これは電子の8重奏なので、O原子を中心に電子を配置すればよい。 9556>
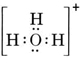
より複雑なケースでは、ルイス構造を描く前に共有電子対の数を計算することがしばしば有用である。 特に、問題のイオンがオキシアニオン(中心原子が複数のO原子に囲まれている)である場合にそうなる。 よく知られているオキシアニオンは炭酸イオンで、式はCO32-である。 (分子の場合と同じように、中心原子Cを先に書くことに注意)。 CO32-で利用できる価電子の総数は
( 4 \{(for C)}) + 3 \times 6 \text{(for O)}. + 2 \text{(for -2 charge)} = 24 \)
これらの電子を4つの原子に分配し、それぞれを1オクテットとすると、4×8=32個の電子が必要となります。 つまり、32 – 24 = 8個の電子を2回数える必要があり、8個の電子が共有されていることになる。 つまり、8個の電子が共有されていることになる。したがって、aイオンは4つの電子対結合を持つことになる。 この図では、4個のC電子をドットで、18個のO電子を×で、余分な2個の電子を色のついたドットで表し、わかりやすくしています。
今描いたルイス構造には重大な異論がある。 酸素原子を区別するものは何もないのに、電子はどの酸素原子と二重結合を作るかどうやって知るのだろうか。 答えは「わからない」である。 CO32-イオンや他の分子の結合を説明するためには、ルイス理論の拡張が必要です。 この問題は、共鳴を議論するときに、さらに追求します。 では、最後に例を挙げて説明します。 価電子の総数は
6(S)+3×6(O)+2(電荷)=26原子4個分のオクテットを作るには32個の電子が必要なので、差の32-26=6が共有電子の数となる。 したがって、このイオンには電子対結合が3つしかない。 8181>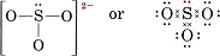
S-O 結合はそれぞれ共有結合であることに注意してください。 Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
.




