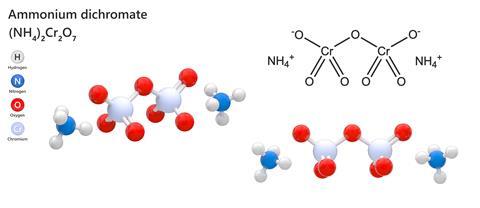
Ammonium dichromaat
Meera Senthilingam
Deze week haalt Brian Clegg herinneringen op aan een eenvoudige maar explosieve verbinding.
Brian Clegg
Van alle chemische verbindingen die je vroeger in een scheikundeset kon vinden voordat alles gezondheids- en veiligheidsgericht was, was ammonium dichromaat misschien wel de meest bevredigende in zijn eenvoud. Deze relatief complexe anorganische verbinding combineert twee ammoniumionen met het dubbelnegatieve Cr2O7 en vormt zo een vrij aantrekkelijk oranje kristal dat er even onschuldig uitziet als kopersulfaat. Maar steek er licht op – verrassend gemakkelijk voor een stof in kristalvorm – en het spuwt grote hoeveelheden vederlicht, donkergroen chroomoxidepoeder uit met een groot aantal feloranje vonken en genoeg indrukwekkende kracht om het de bijnaam ‘Vesuviaans vuur’ te geven. Vergeet modelvulkanen aangedreven door natriumbicarbonaat en azijn, een ammoniumdichromaatvulkaan is het echte werk.

Bron: ©
Om eerlijk te zijn tegen de chemie-set politie, ammoniumdichromaat is een irriterende stof, is giftig, is vrijwel zeker kankerverwekkend en kan ontploffen bij verhitting in een afgesloten vat. De kristalstructuur is thermodynamisch onstabiel, dus als er een vlam of voldoende hitte wordt aangewakkerd, zal het een exotherme reactie op gang brengen die een grote volumevergroting teweegbrengt doordat het grootste deel, maar niet alles, van het dichromaat wordt omgezet in het oxide. Daarbij komt stikstof vrij, en de reactie wordt soms in laboratoria gebruikt om zuiverder stikstof te produceren dan gemakkelijk uit de lucht kan worden gehaald.
De verbinding begint haar leven als het in de natuur voorkomende mineraal chromiet, FeCr2O4, dat in een oven met natriumhydroxide en calciumoxide wordt geroosterd om natriumchromaat te produceren. Het hoofddoel hiervan is dan basischroomsulfaat te produceren, een essentieel voor de leerlooi-industrie, maar een deel wordt verwerkt via natriumdichromaat om het ammoniumzout te produceren.
Industrieel gezien is ammoniumdichromaat een beetje een ‘verbinding van gisteren’. In de begindagen van de fotografie was het een van de vele – meestal gevaarlijke – chemische middelen die werden gebruikt om een beeld vast te leggen. Het meest directe gebruik was in de gom bichromaat fotografie (bichromaat is gewoon een oudere, alternatieve term voor dichromaat).
Ammonium dichromaat zal altijd een beetje een uitslover blijven, een verbinding die altijd voor spanning en sensatie zal blijven zorgen
Het proces dateert uit de jaren 1850 en maakt afdrukken die zowel full colour als monochroom kunnen zijn. Het procédé bestaat erin papier te bedekken met een mengsel van een pigment – meestal een aquarelverf – en Arabische gom, het sap van de acaciaboom, hoewel sommige moderne gebruikers de gom vervangen door PVA-lijm. De laag wordt vervolgens behandeld met ammonium- (en soms kalium-) dichromaat, waardoor ze lichtgevoelig wordt en de gom oxideert, zodat het pigment op zijn plaats blijft waar het licht erop valt. Na blootstelling aan een beeld (door een kleurfilter als een volledig kleurenresultaat vereist is) wordt het gewassen in water, dat het pigment verwijdert dat niet aan licht is blootgesteld. Om extra kleuren toe te voegen, wordt het proces in lagen met verschillende pigmenten herhaald, waardoor een opvallend, meer schilderachtig beeld ontstaat dan bij een traditionele foto.
Gombichromaat wordt tegenwoordig alleen nog door gespecialiseerde liefhebbers gebruikt, net als een andere fotografische toepassing van ammoniumdichromaat, cyanotypedruk in zonlicht. Hierbij wordt de verbinding gemengd met ammoniumijzeroxalaat en kaliumferricyanide en in papier geweekt. Wanneer dat papier droogt, is het lichtgevoelig en wordt het blauw bij blootstelling aan zonlicht. Beelden worden gewoonlijk gemaakt door het papier gedeeltelijk af te schermen met voorwerpen om negatieve schaduwen te vormen.
Hoewel het onwaarschijnlijk is dat het nu nog veel wordt gebruikt, heeft de pyrotechnische industrie ammoniumdichromaat in sommige van haar vuurwerk verwerkt, zowel op zichzelf in vroeg binnenvuurwerk (voordat het als te gevaarlijk werd beschouwd) als in een mengsel om te fungeren als oxidator en expanderende stuwstof.
Bron: ©
Dezelfde geleidelijke terugtrekking uit gebruik zien we bij een andere toepassing van ammoniumdichromaat. Dichromaten bleken effectieve beitsmiddelen bij het verven. Een beitsmiddel was oorspronkelijk een sluiting of de gesp van een gordel – iets dat vasthield – en de term werd overgebracht naar de verfindustrie, waar men een manier zocht om kleurstoffen vast te laten houden aan materialen die ze van nature afstootten. Het beitsmiddel fungeert als een soort tussenpersoon die met de kleurstof een complex vormt dat zich aan een vezel van de stof hecht. Omdat er andere, even doeltreffende maar minder gevaarlijke beitsmiddelen bestaan, wordt ammoniumdichromaat thans nog maar zelden gebruikt.
Een laatste toepassing die veel plotselinger verdween dan het beitsmiddel, was het helpen bij de produktie van schermen voor TV’s en computers. In feite werd het dichromaat gebruikt in een vergelijkbaar proces als gom bichromaat fotografie om clusters van het fosforescerende materiaal op het scherm te hechten als pixels. Het oppervlak werd met het mengsel gecoat, vervolgens aan licht blootgesteld met een schaduwmasker dat het patroon van stippen op het scherm creëerde alvorens het tussenliggende materiaal weg te wassen. Maar de introductie van LCD-, plasma- en LED-schermen heeft de markt waar ammoniumdichromaat zijn laatste hi-tech toepassing had, vrijwel vernietigd, waardoor fosforgebaseerde schermen een zeldzaamheid zijn geworden voor gespecialiseerde gebruikers.
We moeten accepteren dat ammoniumdichromaat, ondanks de ogenschijnlijke onschuldige schoonheid van die glinsterende oranje kristallen, te onveilig is om een speeltje te zijn. Maar onder gecontroleerde omstandigheden kan die gutsende vulkaanreactie nog steeds een brede grijns op het gezicht van de meest cynische chemicus toveren. Ammonium dichromaat zal altijd een beetje een uitslover blijven, een verbinding die altijd voor spanning en sensatie zal zorgen.
Meera Senthilingam
Wetenschapsschrijver Brian Clegg, met de vulkanische chemie van ammonium dichromaat. Volgende week wordt het metabolisch.
Nate Adams
De cytochroom p450s groep van eiwitten zijn misschien wel de belangrijkste moleculaire machines binnen onze cellen. Het zijn de enzymen die het proces starten van het afbreken, of metaboliseren van meestal giftige of gevaarlijke moleculen die ons lichaam niet wil of niet langer nodig heeft.
Meera Senthilingam
Ontdek de chemie hierachter door met Nate Adams mee te doen in Chemie in zijn Element van volgende week. Tot dan, bedankt voor het luisteren, ik ben Meera Senthilingam.




