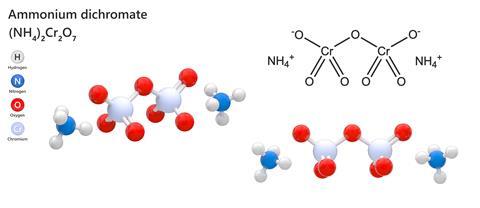
Ammoniumdikromaatti
Meera Senthilingam
Tällä viikolla Brian Clegg muistelee yksinkertaista mutta räjähdysherkkää yhdistettä.
Brian Clegg
Kaikista kemiallisista yhdisteistä, joita saattoi löytyä kemian sarjasta vanhoina hyvinä päivinä, ennen kuin kaikesta oli tehty terveys- ja turvallisuussäädöksiä, ehkä kaikkein tyydyttävin oli ammoniumdikromaatti. Tämä suhteellisen monimutkainen epäorgaaninen yhdiste yhdistää kaksi ammoniumionia kaksoisnegatiivisen Cr2O7:n kanssa muodostaen melko houkuttelevan oranssin kiteen, joka näyttää yhtä harmittomalta kuin kuparisulfaatti. Jos siihen kuitenkin sytytetään valoa – mikä on yllättävän helppoa kiteisessä muodossa olevalle aineelle -, se erittää suuria määriä höyhenenkevyttä, tummanvihreää kromioksidipulveria, jossa on paljon kirkkaan oransseja kipinöitä ja niin paljon vaikuttavaa voimaa, että se sai lempinimen ”Vesuvin tuli”. Unohda natriumbikarbonaatilla ja etikalla toimivat mallitulivuoret, ammoniumdikromaattitulivuori on oikea juttu.

Lähde: ©
Kemian sarjapoliisia kohtaan sanottakoon, että ammoniumdikromaatti on ärsyttävä aine, se on myrkyllinen, se on melkeinpä varmasti syöpää aiheuttava aine, ja se räjähtää, jos sitä kuumennetaan suljetussa astian sisällä. Kiderakenne on termodynaamisesti epästabiili, joten liekin tai riittävän lämmön vaikutuksesta alkaa eksoterminen reaktio, joka johtaa suureen tilavuuden laajenemiseen, kun suurin osa, mutta ei koko dikromaatti muuttuu oksidiksi. Prosessissa vapautuu typpeä, ja reaktiota käytetään joskus laboratorioissa tuottamaan puhtaampaa typpeä kuin mitä ilmasta voidaan helposti ottaa talteen.
Yhdiste alkaa luonnossa esiintyvänä kromiittimineraalina, FeCr2O4, jota paahdetaan uunissa natriumhydroksidin ja kalsiumoksidin kanssa natriumkromaatin tuottamiseksi. Päätavoitteena on sitten tuottaa peruskromisulfaattia, joka on välttämätön nahan parkitsemisteollisuudelle, mutta osa prosessoidaan natriumdikromaatin kautta ammoniumsuolan tuottamiseksi.
Teollisesti ammoniumdikromaatti on hieman ”eilisen päivän yhdiste”. Valokuvauksen alkuaikoina se oli yksi erä kemiallisia tarvikkeita – yleensä vaarallisia – joita käytettiin kuvan ottamiseen. Välittömimmin sitä käytettiin kumibikromaattivalokuvauksessa (bikromaatti on vain vanhempi, vaihtoehtoinen termi dikromaatille).
Ammoniumdikromaatti tulee aina olemaan hieman pröystäilevä yhdiste, joka tulee aina tuottamaan jännitystä
Prosessi juontaa juurensa 1850-luvulta, ja sen avulla saadaan aikaan tulosteita, jotka voivat olla täysvärillisiä tai yksivärisiä. Lähestymistapa on päällystää paperi pigmentin – tyypillisesti akvarellivärin – ja arabikumin, joka on akaasiapuun mahlaa, seoksella, vaikka jotkut nykyaikaiset käyttäjät korvaavatkin arabikumin PVA-liimalla. Tämän jälkeen kerros käsitellään ammoniumdikromaatilla (ja joskus kaliumdikromaatilla), joka tekee siitä valoherkän ja hapettaa purukumin, jolloin pigmentti pysyy paikallaan valon osuessa siihen. Kun kuva on valotettu (värisuodattimen läpi, jos halutaan täysväritulos), se pestään vedellä, joka poistaa pigmentin, joka ei ole altistunut valolle. Lisävärien lisäämiseksi prosessi toistetaan kerroksittain eri pigmenteillä, jolloin saadaan perinteistä valokuvaa näyttävämpi, maalausta muistuttavampi kuva.
Kumibikromaattia käyttävät nykyään vain erikoistuneet harrastajat, samoin kuin ammoniumdikromaatin toista valokuvausmenetelmää, syanotypia-aurinkopainantaa. Siinä yhdiste sekoitetaan ammoniumrautaoksalaatin ja kaliumferrisyanidin kanssa ja liotetaan paperiin. Kun paperi kuivuu, se on valoherkkää ja muuttuu siniseksi, kun se altistuu auringonvalolle. Kuvat valmistetaan yleensä varjostamalla paperi osittain esineillä negatiivisten varjojen muodostamiseksi.
Pyrotekninen teollisuus käytti ammoniumdikromaattia joihinkin ilotulitteisiinsa, sekä sellaisenaan varhaisissa sisätiloissa käytettävissä ilotulitteissa (ennen kuin sitä pidettiin liian vaarallisena) että sekoitettuna seoksena, joka toimi hapettimena ja paisuvana ponneaineena.
Lähde: ©
Samankaltainen asteittainen vetäytyminen käytöstä on nähtävissä toisessa ammoniumdikromaatin käyttökohteessa. Dikromaatit osoittautuivat tehokkaiksi peittausaineiksi värjäyksessä. Mordantti oli alun perin vyön lukko tai solki – jokin, joka piti kiinni – ja termi siirrettiin värjäysalalle, jossa haluttiin saada väriaineet kiinnittymään materiaaleihin, jotka luonnostaan hylkivät niitä. Mordantti toimii eräänlaisena välikappaleena, joka muodostaa väriaineen kanssa kompleksin, joka sitoutuu kankaan kuituun. Koska on olemassa muitakin yhtä tehokkaita mutta vähemmän vaarallisia peittausaineita, ammoniumdikromaattia käytetään nykyään harvoin.
Yksi viimeiseksi käyttökohteeksi, joka katosi paljon äkillisemmin kuin peittausaine, oli avuksi televisioiden ja tietokoneiden näyttöjen valmistukseen. Käytännössä dikromaattia käytettiin samankaltaisessa prosessissa kuin kumibikromaattivalokuvauksessa kiinnittämään fosforisoivan materiaalin klustereita näytölle pikseleiksi. Pinta päällystettiin seoksella, minkä jälkeen se valotettiin valolle varjomaskin avulla, joka loi pistekuvion kuvaruutuun, ennen kuin välimateriaali pestiin pois. LCD-, plasma- ja LED-näyttöjen käyttöönotto on kuitenkin käytännössä tuhonnut markkinat, joilla ammoniumdikromaatilla oli viimeinen hi-tech-sovelluksensa, ja fosforipohjaiset näytöt ovat jääneet harvinaisuudeksi erikoiskäyttäjille.
Meidän on hyväksyttävä, että noiden oransseina kimaltelevien kristallien näennäisestä viattomasta kauneudesta huolimatta ammoniumdikromaatti on liian vaarallinen leikkikaluiksi. Mutta valvotuissa olosuhteissa tuo pursuava tulivuorireaktio voi silti saada kyynisimmänkin kemistin kasvoille leveän virneen. Ammoniumdikromaatti tulee aina olemaan jonkinlainen keulakuva, yhdiste, joka tarjoaa aina jännitystä ja jännitystä.
Meera Senthilingam
Tiedekirjailija Brian Clegg ammoniumdikromaatin vulkaanisen kemian parissa. Ensi viikolla asiat muuttuvat aineenvaihdunnallisiksi.
Nate Adams
Sytokromi p450 -proteiiniryhmä on kenties tärkeimpiä molekyylikoneita soluissamme. Ne ovat entsyymejä, jotka käynnistävät prosessin, jossa hajotetaan tai metabolisoidaan yleensä myrkyllisiä tai vaarallisia molekyylejä, joita elimistömme ei halua tai joita se ei enää tarvitse.
Meera Senthilingam
Osaa tietää, mitä kemiaa tämän takana on, liittymällä Nate Adamsin seuraan ensi viikon Kemia elementissään -ohjelmassa. Siihen asti kiitos kuuntelemisesta, olen Meera Senthilingam.




