Dicromato di ammonio
Meera Senthilingam
Questa settimana, Brian Clegg ricorda un composto semplice ma esplosivo.
Brian Clegg
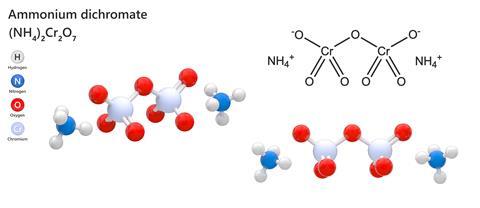
Di tutti i composti chimici che si potevano trovare in un set di chimica ai vecchi tempi, prima che tutto fosse improntato alla sicurezza, forse il più soddisfacente nella sua semplicità era il dicromato di ammonio. Questo composto inorganico relativamente complesso combina due ioni di ammonio con il doppiamente negativo Cr2O7 per formare un cristallo arancione piuttosto attraente che sembra innocuo come il solfato di rame. Ma se gli si dà luce – sorprendentemente facile per una sostanza in forma cristallina – sputa fuori grandi quantità di polvere di ossido di cromo verde scuro con una serie di scintille arancioni brillanti e abbastanza forza impressionante da dargli il soprannome di “fuoco vesuviano”. Dimenticate i modellini di vulcani alimentati da bicarbonato di sodio e aceto, un vulcano di dicromato di ammonio è un vero affare.

Fonte: ©
Per essere giusti nei confronti della polizia di chimica, il dicromato di ammonio è irritante, è velenoso, è quasi certamente cancerogeno e rischia di esplodere se riscaldato in un contenitore sigillato. La struttura cristallina è termodinamicamente instabile, quindi se si innesca una fiamma o un calore sufficiente, inizierà una reazione esotermica che produrrà una grande espansione di volume quando la maggior parte, ma non tutto, del bicromato si converte in ossido. Nel processo, viene emesso azoto, e la reazione è talvolta usata nei laboratori per produrre azoto più puro di quello che può essere facilmente estratto dall’aria.
Il composto inizia la vita come cromite minerale naturale, FeCr2O4, che viene arrostito in un forno con idrossido di sodio e ossido di calcio per produrre cromato di sodio. Lo scopo principale è poi quello di produrre solfato di cromo di base, essenziale per l’industria della concia delle pelli, ma una parte viene lavorata attraverso il bicromato di sodio per produrre il sale di ammonio.
Industrialmente, il bicromato di ammonio è un po’ un “composto di ieri”. Nei primi tempi della fotografia, era uno di una serie di forniture chimiche – di solito pericolose – che venivano impiegate per catturare un’immagine. L’uso più diretto era nella fotografia al bicromato di gomma (bicromato è solo un vecchio termine alternativo per dicromato).
Il bicromato di ammonio sarà sempre un po’ uno spettacolo, un composto che darà sempre emozioni e brividi
Il processo risale al 1850 e produce stampe che possono essere a colori o monocromatiche. L’approccio adottato è quello di rivestire la carta in una miscela di un pigmento – tipicamente una vernice per acquerello – e gomma arabica, che è la linfa dell’albero di acacia, anche se alcuni utenti moderni sostituiscono la gomma con la colla PVA. Lo strato viene poi trattato con dicromato di ammonio (e a volte di potassio), che lo rende sensibile alla luce, ossidando la gomma per tenere il pigmento in posizione dove la luce lo colpisce. Dopo l’esposizione di un’immagine (attraverso un filtro a colori se è richiesto un risultato a colori) viene lavata in acqua, che porta via il pigmento che non ha avuto l’esposizione alla luce. Per aggiungere altri colori, il processo viene ripetuto a strati con diversi pigmenti, producendo un’immagine suggestiva, più simile a un dipinto che a una fotografia tradizionale.
Il bicromato di gomma è usato oggi solo da appassionati specializzati, così come un altro uso fotografico del bicromato di ammonio, la stampa cianotipia al sole. Qui il composto è mescolato con ossalato di ferro di ammonio e ferricianuro di potassio e imbevuto di carta. Una volta che la carta si asciuga è fotosensibile, diventando blu all’esposizione alla luce del sole. Le immagini sono di solito fatte schermando parzialmente la carta con oggetti per formare ombre negative.
Anche se è improbabile che venga usato molto oggi, l’industria pirotecnica ha incorporato il bicromato di ammonio in alcuni dei suoi fuochi d’artificio, sia da solo nei primi fuochi d’artificio da interno (prima che fosse considerato troppo pericoloso) che in una miscela per agire come ossidante e propellente espandente.
Fonte: ©
Possiamo vedere lo stesso graduale ritiro dall’uso in un’altra delle applicazioni del dicromato di ammonio. I bicromati si sono dimostrati efficaci mordenti nella tintura. Un mordente era originariamente un fermaglio o la fibbia di una cintura – qualcosa che si teneva stretto – e il termine fu trasferito all’industria della tintura, dove si voleva un modo per far sì che i coloranti si attaccassero a materiali che naturalmente li respingevano. Il mordente agisce come una sorta di intermediario, formando un complesso con il colorante che si legherà a una fibra del tessuto. Poiché ci sono altri mordenti ugualmente efficaci ma meno pericolosi, il bicromato di ammonio è ora usato raramente.
Un’ultima applicazione che è scomparsa molto più improvvisamente del mordente è stata quella di aiutare nella produzione di schermi per TV e computer. In effetti, il bicromato era usato in un processo simile a quello della fotografia al bicromato di gomma per attaccare grappoli di materiale fosforescente allo schermo come pixel. La superficie era rivestita con la miscela, poi esposta alla luce con una maschera d’ombra che creava il modello di punti sullo schermo prima di lavare via il materiale intermedio. Ma l’introduzione degli schermi LCD, plasma e LED ha praticamente distrutto il mercato in cui il bicromato di ammonio ha avuto la sua ultima applicazione hi-tech, lasciando gli schermi a base di fosforo una rarità per gli utenti specializzati.
Dobbiamo accettare che nonostante l’apparente innocente bellezza di quei cristalli arancioni scintillanti, il bicromato di ammonio è troppo pericoloso per essere un giocattolo. Ma in condizioni controllate, quella reazione zampillante del vulcano può ancora produrre un ampio sorriso sul volto del più cinico dei chimici. Il bicromato di ammonio sarà sempre un po’ uno spettacolo, un composto che darà sempre emozioni e brividi.
Meera Senthilingam
Scienza scrittore Brian Clegg, con la chimica vulcanica del bicromato di ammonio. La prossima settimana, le cose diventano metaboliche.
Nate Adams
Il gruppo di proteine del citocromo p450s sono forse le più importanti macchine molecolari all’interno delle nostre cellule. Sono gli enzimi che iniziano il processo di scomposizione, o metabolizzazione delle molecole solitamente tossiche o pericolose che il nostro corpo non vuole o non ha più bisogno.
Meera Senthilingam
E scopri la chimica che c’è dietro a questo unendo Nate Adams nella prossima settimana di Chemistry in its Element. Fino ad allora, grazie per aver ascoltato, sono Meera Senthilingam.




