Ammoniumdikromat
Meera Senthilingam
Denna vecka minns Brian Clegg en enkel men explosiv förening.
Brian Clegg
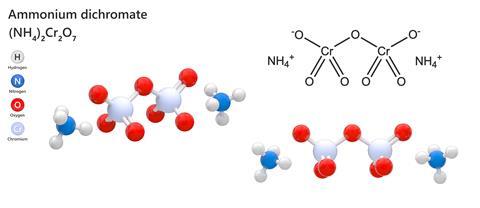
Av alla kemiska föreningar som man kunde hitta i en kemisats på den gamla goda tiden innan allting var hälsovårdande och säkerhetsmässigt reglerat, var kanske den mest tillfredsställande i sin enkelhet ammoniumdikromat. Denna relativt komplexa oorganiska förening kombinerar två ammoniumjoner med det dubbelt negativa Cr2O7 för att bilda en ganska attraktiv orange kristall som ser lika ofarlig ut som kopparsulfat. Men om man tänder ljus på den – vilket är förvånansvärt lätt att göra för en substans i kristallin form – spottar den ut stora mängder fjäderlätt, mörkgrönt kromoxidpulver med en mängd ljusorange gnistor och tillräckligt imponerande kraft för att ge den smeknamnet ”Vesuvianska elden”. Glöm modellvulkaner som drivs av natriumbikarbonat och vinäger, en ammoniumdikromatvulkan är den riktiga varan.

Källa: ©
För att vara rättvis mot kemisättningspolisen är ammoniumdikromat irriterande, giftigt, med största sannolikhet cancerframkallande och exploderar om det upphettas i en sluten behållare. Kristallstrukturen är termodynamiskt instabil, så om den utlöses av en låga eller tillräcklig värme kommer den att påbörja en exotermisk reaktion som kommer att ge upphov till en stor volymexpansion när det mesta, men inte allt dikromat, omvandlas till oxid. I processen avges kväve, och reaktionen används ibland i laboratorier för att producera renare kväve än vad som lätt kan utvinnas ur luften.
Förbindelsen börjar sitt liv som det naturligt förekommande mineralet kromit, FeCr2O4, som rostas i en ugn med natriumhydroxid och kalciumoxid för att producera natriumkromat. Huvudsyftet med detta är sedan att producera basiskt kromsulfat, som är viktigt för lädergarvningsindustrin, men en del bearbetas via natriumdikromat för att producera ammoniumsaltet.
Industriellt sett är ammoniumdikromat lite av en ”gårdagens förening”. I fotografins tidiga dagar var det en av en rad kemiska förnödenheter – vanligtvis farliga – som användes för att fånga en bild. Den mest direkta användningen var i gummibikromatfotografering (bikromat är bara en äldre, alternativ term för dikromat).
Ammoniumdikromat kommer alltid att vara lite av en uppvisning, en förening som alltid kommer att leverera spänning och spänning
Processen har anor från 1850-talet och ger utskrifter som kan vara i färg eller monokroma. Den metod som används är att belägga papper med en blandning av ett pigment – vanligtvis en akvarellfärg – och gummi arabicum, som är saft från akaciaträdet, även om vissa moderna användare ersätter gummit med PVA-lim. Skiktet behandlas sedan med ammoniumdikromat (och ibland kaliumdikromat), vilket gör det ljuskänsligt och oxiderar gummit för att hålla pigmentet på plats där ljuset träffar det. Efter exponering för en bild (genom ett färgfilter om man vill ha ett färgresultat) tvättas det i vatten, vilket tar bort det pigment som inte har exponerats för ljus. För att lägga till ytterligare färger upprepas processen i lager med olika pigment, vilket ger en slående, mer måleriliknande bild än ett traditionellt fotografi.
Gummibikromat används idag endast av specialiserade entusiaster, liksom ett annat fotografiskt användningsområde för ammoniumdikromat, cyanotypi-soltryck. Här blandas föreningen med ammoniumjärnoxalat och kaliumferricyanid och blötläggs i papper. När pappret torkar är det ljuskänsligt och blir blått när det utsätts för solljus. Bilderna framställs vanligen genom att man delvis skärmar av pappret med föremål för att bilda negativa skuggor.
Och även om det är osannolikt att det används mycket nu, så använde den pyrotekniska industrin ammoniumdikromat i vissa av sina fyrverkerier, både som sådant i tidiga fyrverkerier för inomhusbruk (innan det ansågs vara för farligt) och i en blandning för att fungera som oxidationsmedel och expanderande drivmedel.
Källa: ©
Vi kan se samma gradvisa tillbakadragande från användningen i ett annat av användningsområdena för ammoniumdikromat. Dikromater visade sig vara effektiva betmedel vid färgning. Ett betningsmedel var ursprungligen ett spänne eller spänne på ett bälte – något som höll fast – och termen överfördes till färgningsindustrin, där man ville ha ett sätt att få färgämnen att hålla fast vid material som naturligt stöttade bort dem. Betningsmedlet fungerar som ett slags mellanled och bildar ett komplex med färgämnet som binder sig till en fiber i tyget. Eftersom det finns andra lika effektiva men mindre farliga betningsmedel används ammoniumdikromat numera sällan.
En sista tillämpning som försvann mycket plötsligare än betningsmedlet var att hjälpa till vid tillverkningen av skärmar till TV-apparater och datorer. Dikromaten användes i själva verket i en liknande process som gummibikromatfotografering för att fästa kluster av det fosforescerande materialet på skärmen som pixlar. Ytan belades med blandningen och exponerades sedan för ljus med en skuggmask som skapade mönstret av prickar på skärmen innan det mellanliggande materialet tvättades bort. Men införandet av LCD-, plasma- och LED-skärmar har praktiskt taget förstört den marknad där ammoniumdikromat hade sin sista högteknologiska tillämpning, och fosforbaserade skärmar är numera en sällsynthet för specialiserade användare.
Vi måste acceptera att trots den skenbart oskyldiga skönheten hos dessa glittrande orangefärgade kristaller är ammoniumdikromat för osäkert för att vara en leksak. Men under kontrollerade förhållanden kan den sprudlande vulkanreaktionen fortfarande framkalla ett brett flin hos den mest cyniska kemisten. Ammoniumdikromat kommer alltid att vara lite av en uppvisare, en förening som alltid kommer att leverera spänning och spänning.
Meera Senthilingam
Vetenskapsskribenten Brian Clegg, med den vulkaniska kemin i ammoniumdikromat. Nästa vecka blir det metaboliskt.
Nate Adams
Proteingruppen cytokrom p450s är kanske de viktigaste molekylära maskinerna i våra celler. De är de enzymer som startar processen att bryta ner, eller metabolisera vanligtvis giftiga eller farliga molekyler som våra kroppar inte vill ha eller inte längre behöver.
Meera Senthilingam
Och upptäck kemin bakom detta genom att följa med Nate Adams i nästa veckas Kemi i sitt element. Tack för att du lyssnar tills dess, jag är Meera Senthilingam.




