Dichromate d’ammonium
Meera Senthilingam
Cette semaine, Brian Clegg se souvient d’un composé simple mais explosif.
Brian Clegg
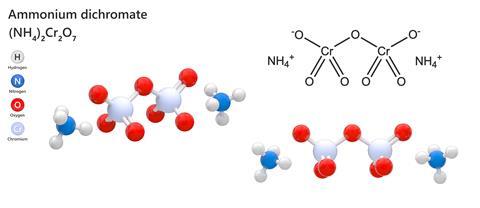
De tous les composés chimiques que l’on pouvait trouver dans un coffret de chimie à l’époque où tout n’était pas encore sécurisé en matière de santé et de sécurité, le plus satisfaisant dans sa simplicité était peut-être le bichromate d’ammonium. Ce composé inorganique relativement complexe combine deux ions ammonium avec le Cr2O7 doublement négatif pour former un cristal orange plutôt attrayant qui semble aussi inoffensif que le sulfate de cuivre. Mais il suffit de l’allumer – ce qui est étonnamment facile pour une substance sous forme cristalline – pour qu’il crache de grandes quantités de poudre d’oxyde de chrome plumeuse, vert foncé, accompagnée d’une multitude d’étincelles orange vif et d’une force suffisamment impressionnante pour lui donner le surnom de « feu vésuvien ». Oubliez les modèles réduits de volcans alimentés par du bicarbonate de sodium et du vinaigre, un volcan de bichromate d’ammonium est une vraie affaire.

Source : ©
Pour être juste envers la police des plateaux de chimie, le bichromate d’ammonium est un irritant, est toxique, est presque certainement cancérigène et est susceptible d’exploser s’il est chauffé dans un récipient scellé. La structure cristalline est instable d’un point de vue thermodynamique. Par conséquent, sous l’effet d’une flamme ou d’une chaleur suffisante, il déclenchera une réaction exothermique qui entraînera une forte expansion du volume, la majeure partie, mais pas la totalité, du dichromate se transformant en oxyde. Au cours du processus, de l’azote est dégagé, et la réaction est parfois utilisée dans les laboratoires pour produire de l’azote plus pur que celui qui peut être facilement extrait de l’air.
Le composé commence sa vie sous la forme du minéral naturel qu’est la chromite, FeCr2O4, qui est grillé dans un four avec de l’hydroxyde de sodium et de l’oxyde de calcium pour produire du chromate de sodium. L’objectif principal est alors de produire du sulfate de chrome basique, essentiel pour l’industrie du tannage du cuir, mais une partie est traitée via le bichromate de sodium pour produire le sel d’ammonium.
Industriellement, le bichromate d’ammonium est un peu un « composé d’hier ». Aux débuts de la photographie, il faisait partie d’un lot de fournitures chimiques – généralement dangereuses – qui étaient employées pour capturer une image. L’utilisation la plus directe était la photographie au bichromate de gomme (le bichromate n’est qu’un terme alternatif plus ancien pour bichromate).
Le bichromate d’ammonium sera toujours un peu frimeur, un composé qui procurera toujours des sensations fortes
Le procédé remonte aux années 1850 et permet de réaliser des tirages qui peuvent être en couleur ou monochromes. L’approche adoptée consiste à enduire le papier d’un mélange de pigment – typiquement une peinture aquarelle – et de gomme arabique, qui est la sève de l’acacia, bien que certains utilisateurs modernes remplacent la gomme par de la colle PVA. La couche est ensuite traitée avec du bichromate d’ammonium (et parfois de potassium), qui la rend sensible à la lumière, en oxydant la gomme pour maintenir le pigment en place là où la lumière le frappe. Après avoir été exposée à une image (à travers un filtre de couleur si un résultat en couleur est requis), elle est lavée à l’eau, ce qui élimine le pigment qui n’a pas été exposé à la lumière. Pour ajouter des couleurs supplémentaires, le processus est répété en couches avec différents pigments, produisant une image saisissante, plus proche de la peinture qu’une photographie traditionnelle.
Le bichromate de gomme n’est aujourd’hui utilisé que par des passionnés spécialisés, tout comme une autre utilisation photographique du bichromate d’ammonium, le tirage solaire cyanotype. Dans ce cas, le composé est mélangé avec de l’oxalate de fer d’ammonium et du ferricyanure de potassium, puis trempé dans du papier. Une fois que le papier a séché, il est photosensible et devient bleu lorsqu’il est exposé à la lumière du soleil. Les images sont généralement réalisées en tramant partiellement le papier avec des objets pour former des ombres négatives.
Bien qu’il soit peu probable qu’il soit beaucoup utilisé aujourd’hui, l’industrie pyrotechnique a incorporé le bichromate d’ammonium dans certains de ses feux d’artifice, à la fois seul dans les premiers feux d’artifice d’intérieur (avant qu’il ne soit considéré comme trop dangereux) et dans un mélange pour agir comme oxydant et propulseur en expansion.
Source : ©
On peut observer le même retrait progressif de l’utilisation dans une autre des applications du bichromate d’ammonium. Les bichromates se sont avérés des mordants efficaces en teinture. À l’origine, un mordant était un fermoir ou la boucle d’une ceinture – quelque chose qui tenait fermement – et le terme a été transféré à l’industrie de la teinture, qui cherchait un moyen de faire tenir les colorants sur des matériaux qui les repoussaient naturellement. Le mordant agit comme une sorte d’intermédiaire, formant un complexe avec le colorant qui se fixera sur une fibre du tissu. Comme il existe d’autres mordants tout aussi efficaces mais moins dangereux, le bichromate d’ammonium est aujourd’hui rarement utilisé.
Une dernière application qui a disparu beaucoup plus soudainement que le mordant était d’aider à la production d’écrans pour les téléviseurs et les ordinateurs. En effet, le bichromate était utilisé dans un processus similaire à celui de la photographie au bichromate de gomme pour fixer des amas de la matière phosphorescente sur l’écran sous forme de pixels. La surface était recouverte du mélange, puis exposée à la lumière à l’aide d’un masque d’ombre qui créait le motif des points sur l’écran avant de laver le matériau intermédiaire. Mais l’introduction des écrans LCD, plasma et LED a pratiquement détruit le marché où le bichromate d’ammonium avait sa dernière application de haute technologie, laissant les écrans à base de phosphore comme une rareté pour les utilisateurs spécialisés.
Nous devons accepter que malgré la beauté innocente apparente de ces cristaux orange scintillants, le bichromate d’ammonium est trop dangereux pour être un jouet. Mais dans des conditions contrôlées, cette réaction volcanique jaillissante peut encore produire un large sourire sur le visage du plus cynique des chimistes. Le bichromate d’ammonium sera toujours un peu une frime, un composé qui procurera toujours des sensations fortes.
Meera Senthilingam
L’écrivain scientifique Brian Clegg, avec la chimie volcanique du bichromate d’ammonium. La semaine prochaine, les choses deviennent métaboliques.
Nate Adams
Le groupe de protéines cytochrome p450s est probablement la plus importante machine moléculaire de nos cellules. Ce sont les enzymes qui démarrent le processus de décomposition, ou de métabolisation des molécules habituellement toxiques ou dangereuses dont notre corps ne veut pas ou dont il n’a plus besoin.
Meera Senthilingam
Découvrez la chimie derrière tout cela en rejoignant Nate Adams dans l’émission La chimie dans son élément de la semaine prochaine. D’ici là, merci de votre écoute, je suis Meera Senthilingam.




